题目内容
【题目】某温度在密闭容器发生:3H2(g)+N2(g) ![]() 2NH3(g),若开始时只充入2 mol NH3 (g),达平衡时,混合气体的平均摩尔质量等于10. 625g/moL;若开始时只充入3mol H2和1 mol N2的混合气体,达平衡时H2的转化率为( )
2NH3(g),若开始时只充入2 mol NH3 (g),达平衡时,混合气体的平均摩尔质量等于10. 625g/moL;若开始时只充入3mol H2和1 mol N2的混合气体,达平衡时H2的转化率为( )
A.20%
B.40%
C.60%
D.80%
【答案】B
【解析】
3H2(g)+ | N2(g) | 2NH3(g) | |
起始(mol) | 0 | 0 | 2 |
转化(mol) | 3x | x | 2x |
平衡(mol) | 3x | x | 2-2x |
混合气体的平均摩尔质量等于10. 625g/moL= ![]() ,解得:x=0.6mol,若开始时只充入3mol H2和1 mol N2的混合气体,与原平衡等效,平衡时氢气的物质的量为1.8mol,平衡时H2的转化率为
,解得:x=0.6mol,若开始时只充入3mol H2和1 mol N2的混合气体,与原平衡等效,平衡时氢气的物质的量为1.8mol,平衡时H2的转化率为 ![]() ×100%=40%。
×100%=40%。
所以答案是:B
【考点精析】认真审题,首先需要了解等效平衡(在条件不变时,可逆反应不论采取何种途径,即由正反应开始或由逆反应开始,最后所处的平衡状态是相同;一次投料或分步投料,最后所处平衡状态是相同的,某一可逆反应的平衡状态只与反应条件(物质的量浓度、温度、压强或体积)有关,而与反应途径(正向或逆向)无关).

【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是
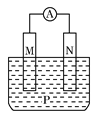
M | N | P | |
A | Zn | Cu | 稀H2SO4溶液 |
B | Cu | Fe | 稀HCl溶液 |
C | Ag | Zn | AgNO3溶液 |
D | Zn | Fe | Fe(NO3)3溶液 |
A. A B. B C. C D. D
【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。化学原理:CH2=CH2(g)+H2O(g)→CH3CH2OH(g)△H。已知几种共价键的键能如下表所示:
化学健 | C-H | C=C | H-O | C-C | C-O |
健能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是( )
A. 上述合成乙醇的反应是加成反应
B. 相同时间段内,反应中用三种物质表示的反应速率相等
C. 碳碳双键的键能小于碳碳单键键能的2倍
D. 上述反应式中,△H=-96kJ·mol-1
