题目内容
(14分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
|
a |
|
|
|||||
|
|
|
|
b |
c |
d |
|
|
|
e |
|
f |
|
|
g |
|
|
(1) f元素在周期表中的位置是第 周期第 族。
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
(每空2分,共14分)(1) 3 IIIA (4分) (2)NaOH+Al(OH)3=NaAlO2+2H2O (2分)
(3)
离子键、共价键 (4分) (4) 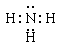 (2分) H2O(2分)
(2分) H2O(2分)
【解析】考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可判断,a~g分别是H、C、N、O、Na、Al、S。
(1)铝元素位于第三周期第ⅢA。
(2)氢氧化铝是两性氢氧化物,能和氢氧化钠反应,方程式为NaOH+Al(OH)3=NaAlO2+2H2O。
(3)钠在空气中的燃烧产物是过氧化钠,其中含有离子键和非极性键。
(4)氨气是含有极性键的共价化合物,电子式为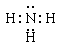 。同周期自左向右非金属性逐渐增强,相应氢化物的稳定性也逐渐增强,所以水的稳定性要强于氨气的
。同周期自左向右非金属性逐渐增强,相应氢化物的稳定性也逐渐增强,所以水的稳定性要强于氨气的

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案(共14分)下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
|
| ⅠA |
|
|
|
|
|
| 0 |
| 1 |
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
| 2 |
|
|
| D | E |
| G | I |
| 3 | A | B | C |
| F |
| H |
|
(1)表中元素,化学性质最不活泼的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)要证明A、B、C的金属活泼性,可以用什么实验来证明,试举一例
实验操作 ;
实验现象: ;
有关化学方程式:
(4)G与H的气态氢化物稳定性 > ,说明相应单质的非金属性 > 。
(共14分)下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
 | ⅠA | | | | | | | 0 |
| 1 | | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | D | E | | G | I |
| 3 | A | B | C | | F | | H | |
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)要证明A、B、C的金属活泼性,可以用什么实验来证明,试举一例
实验操作 ;
实验现象: ;
有关化学方程式:
(4)G与H的气态氢化物稳定性 > ,说明相应单质的非金属性 > 。
(共14分)下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
|
|
ⅠA |
|
|
|
|
|
|
0 |
|
1 |
|
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
D |
E |
|
G |
I |
|
3 |
A |
B |
C |
|
F |
|
H |
|
(1)表中元素,化学性质最不活泼的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)要证明A、B、C的金属活泼性,可以用什么实验来证明,试举一例
实验操作 ;
实验现象: ;
有关化学方程式:
(4)G与H的气态氢化物稳定性 > ,说明相应单质的非金属性 > 。



