题目内容
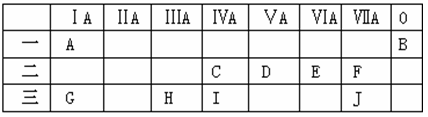
(14分)下表是元素周期表的前三周期,回答下列问题:
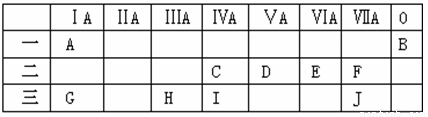
(1)可用于半导体材料的元素是 (填元素符号),它在元素周期表中的位置为 ;
(2)A、G两种元素分别与E元素都能形成两种化合物,其中属于离子化合物的是 (写化学式,下同),属于共价化合物的是 ;这四种化合物中含有非极性键的化合物是 。
(3)表格中十种元素的最高价氧化物对应的水化物中,碱性最强的是 ,属于两性氢氧化物的是 (用化学式表示);
(4)只含有A、C两种元素的化合物称做 ,这些化合物中相对分子质量最小的是 ,该化合物分子的空间构型是 ;
(5)画出元素H的原子结构示意图 ,元素H与元素J组成的化合物的水溶液中加入少量烧碱溶液,反应的离子方程式为 。
(6)由元素A、D、J组成的既含有离子键又含有共价键的化合物的化学式为 。
(方程式2分,其余每空1分,共14分)
(1) Si 第3周期ⅣA族 (2) Na2O 、 Na2O2 ; H2O、H2O2 ;H2O2 、Na2O2
(3) NaOH Al(OH)3 (4) 烃 甲烷 正四面体
(5)  Al3++3OH-=
Al(OH)3 ↓ (6)NH4Cl
Al3++3OH-=
Al(OH)3 ↓ (6)NH4Cl
【解析】(1)可用于半导体材料的元素是Si,位于第三周期第ⅣA。
(2)A、G两种元素分别H和Na,E是O,其中属于离子化合物的是氧化钠、过氧化钠。属于共价化合物的是水和双氧水。过氧化钠和双氧水中都含有非极性键。
(3)金属性越强,最高价氧化物的水化物的碱性越强,钠的金属性最强,所以氢氧化钠的碱性最强,氢氧化铝是两性氢氧化物。
(4)A、C两种元素是碳和氢,形成的化合物是烃类,这些化合物中相对分子质量最小的是甲烷,甲烷是正四面体结构。
(5)H是铝,质子数为13,原子结构示意图为 。J是氯元素,氯化铝和少量氢氧化钠反应生成氢氧化铝白色沉淀,方程式为Al3++3OH-= Al(OH)3
↓ 。
。J是氯元素,氯化铝和少量氢氧化钠反应生成氢氧化铝白色沉淀,方程式为Al3++3OH-= Al(OH)3
↓ 。
(6)元素A、D、J分别是H、N、Cl,组成的既含有离子键又含有共价键的化合物是氯化铵,其化学式为NH4Cl 。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(共14分)下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
|
| ⅠA |
|
|
|
|
|
| 0 |
| 1 |
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
| 2 |
|
|
| D | E |
| G | I |
| 3 | A | B | C |
| F |
| H |
|
(1)表中元素,化学性质最不活泼的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)要证明A、B、C的金属活泼性,可以用什么实验来证明,试举一例
实验操作 ;
实验现象: ;
有关化学方程式:
(4)G与H的气态氢化物稳定性 > ,说明相应单质的非金属性 > 。
(共14分)下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
 | ⅠA | | | | | | | 0 |
| 1 | | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | D | E | | G | I |
| 3 | A | B | C | | F | | H | |
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)要证明A、B、C的金属活泼性,可以用什么实验来证明,试举一例
实验操作 ;
实验现象: ;
有关化学方程式:
(4)G与H的气态氢化物稳定性 > ,说明相应单质的非金属性 > 。
(共14分)下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
|
|
ⅠA |
|
|
|
|
|
|
0 |
|
1 |
|
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
D |
E |
|
G |
I |
|
3 |
A |
B |
C |
|
F |
|
H |
|
(1)表中元素,化学性质最不活泼的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)要证明A、B、C的金属活泼性,可以用什么实验来证明,试举一例
实验操作 ;
实验现象: ;
有关化学方程式:
(4)G与H的气态氢化物稳定性 > ,说明相应单质的非金属性 > 。