题目内容
【题目】在一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g) ![]() CO2(g)+2H2(g),其相关数据如下表所示:
CO2(g)+2H2(g),其相关数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2 | 4 | 3.2 | 2.8 |
乙 | 1 | T2 | 1 | 2 | 1.2 | 3.0 |
(1)T1 _________T2 (填“>”、“<”或“=”)
(2)达到平衡后,保持温度和体积不变,向甲容器内再充入0.8molH2O和3.2molH2,则此时V正________V逆(填“>”、“<”或“=”)
(3)在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_______________.
A.V逆(CO2)=2V正(H2)
B混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均相对分子质量保持不变
(4)某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
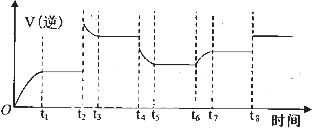
可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是_______________,则从t1到t8哪个时间段H2O (g)的平衡转化率最低_________,(填“t1~t2,以此类推”)。
【答案】
(1)>;(2)=;(3)BD;(4)通入H2O;t7-t8;
【解析】(1)容器甲和乙中水蒸气的浓度相等,达到平衡所需的时间越短,反应速率越快,因此T1 >T2,故答案为:>;
(2) 甲中:C(s)+2H2O(g) ![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
起始(mol/L) 2 0 0
反应 1.6 0.8 1.6
平衡 0.4 0.8 1.6
改变条件后 0.8 0.8 3.2
Qc=![]() =12.8=K=
=12.8=K=![]() =12.8,仍为平衡状态,V正=V逆,故答案为:=;
=12.8,仍为平衡状态,V正=V逆,故答案为:=;
(3) A.V逆(CO2)=2V正(H2)表示的正逆反应速率不等,表示平衡状态,错误;B.该反应属于气体的质量分数变化的反应,当容器的体积不变,混合气体的密度保持不变时,说明气体的质量不变,表示达到了平衡状态,正确;C.c(H2O):c(CO2):c(H2)=2:1:2,不能说明物质的浓度是否变化,不能说明是否达到平衡状态,错误;D.该反应属于气体的物质的量和质量均分数变化的反应,混合气体的平均相对分子质量保持不变,表示达到了平衡状态,正确;故选BD;
(4)t1到t6平衡都逆向移动,而t6时平衡正向移动,是因为增加反应物的浓度,而C是固体,所以是增加水蒸气的量,所以本身的转化率降低,t8时反应速率增大,但平衡不移动,故平衡转化率最低t7-t8 (或“t7到t8”),t6时刻速率逆反应速率在原来基础上增大,平衡逆向移动,所以是通入H2O,故答案为:通入H2O;t7-t8。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案