题目内容
1.下列说法不正确的是( )| A. | 在指定状态下各物质的焓值都是确定且是唯一的 | |
| B. | 当同一个化学反应以不同的过程完成时,反应的焓变是不同的 | |
| C. | 如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓变为相关化学反应的焓变的代数和 | |
| D. | 对于一个化学反应,无论经过哪些步骤从反应物变成生成物,反应的焓变是一样的 |
分析 A、焓值与物质的状态有关;
B、盖斯定律可知反应的焓变只与始态与终态有关;
C、焓变决定于反应物和生成物的能量差;
D、根据盖斯定律判断,反应物和生成物的焓一定,和变化过程无关.
解答 解:A、焓值与物质的状态有关,所以在指定状态下各物质的焓值都是确定且是唯一的,故A正确;
B、反应的焓变只与始态与终态有关,则当同一个化学反应以不同的过程完成时,反应的焓变是相同的,故B错误.
C、焓变的大小决定于反应物和生成物的能量差,和反应过程无关,故B正确;
D、反应热与反应的始末状态有关,与反应途径无关,故D正确;
故选B.
点评 本题是对化学变化与能量的考查,主要考查学生的分析能力和基本理论的运用的考查,题目难度不大.

练习册系列答案
相关题目
12.以下四组物质的水溶液,其中仅用溶液间的两两混合,就可以完成鉴别任务的是( )
| A. | MgCl2 Na2SO4 BaCl2 KOH | |
| B. | BaCl2 AgNO3 CaCl2 HNO3 | |
| C. | NaOH Na2SO4 KNO3 HCl | |
| D. | HCl Na2CO3 Na2SO4 BaCl2 |
9.2009年4月16日CCTV《科技博览》报道,中国科学院首创用CO2合成可降解塑料聚二氧化碳.下列相关说法不合理的是( )
| A. | 二氧化碳塑料是通过加聚反应制得的 | |
| B. | 用上业废弃物二氧化碳生产塑料,有助于缓解温室效应 | |
| C. | 二氧化碳塑料不能在空气中燃烧 | |
| D. | 聚二氧化碳塑料的使用会产生白色污染 |
6.在a g水中投入b g某固体物质,完全溶解后,所得溶液的溶质的质量分数为$\frac{100b}{a+b}$%,该固体是(提示:溶质不一定是所加入的物质)( )
| A. | Na | B. | Na2O2 | C. | Na2O | D. | Na2CO3 |
13.下列化学方程式中.对电子转移情况分析不正确的是( )
| A. | 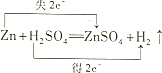 | B. |  | ||
| C. | 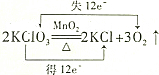 | D. |  |
 根据如图回答问题:
根据如图回答问题:
