题目内容
【题目】已知某混合物含有A单质与化合物B,在一定条件下可按图所示发生转化。
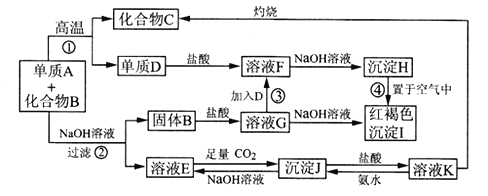
(1)沉淀H变沉淀I的化学方程式_____________________________。
(2)反应②的化学方程式_____________________________。
(3)溶液E中通入过量二氧化碳的离子方程式_______________________________。
(4)用化学反应方程式和简洁的语言解释图中溶液K制取化合物C的过程: __________。
(5)若要保存F溶液,应向溶液中加入两种物质为:_________、________(填化学式)。
【答案】 4Fe(OH)2+ O2+ 2H2O=4Fe(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- AlCl3+3H2O![]() Al(OH)3+3HCl ,加热促进AlCl3水解,生成HCl气体易挥发促进平衡的正向移动,生成Al(OH)3,最终受热Al(OH)3生成Al2O3 Fe HCl
Al(OH)3+3HCl ,加热促进AlCl3水解,生成HCl气体易挥发促进平衡的正向移动,生成Al(OH)3,最终受热Al(OH)3生成Al2O3 Fe HCl
【解析】红褐色沉淀I为氢氧化铁,沉淀H置于空气中变成I,推出H为氢氧化亚铁,再利用其他信息和逆向推理得出D为Fe,F为FeCl2,B为Fe2O3,G为FeCl3;利用E、J、K之间的转化关系,结合有关知识和直觉判断E为NaAlO2,J为氢氧化铝,K为AlCl3,经进一步验证猜测成立,最后推出A为Al,B为Fe2O3,C为Al2O3,则
(1)根据以上分析可知沉淀H转化为沉淀I的化学方程式为4Fe(OH)2+ O2+ 2H2O=4Fe(OH)3。(2)反应②为金属铝和氢氧化钠溶液的反应,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。(3)溶液E中通入过量二氧化碳生成氢氧化铝和碳酸氢钠,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。(4)氯化铝水解:AlCl3+3H2O![]() Al(OH)3+3HCl,水解吸热,加热促进AlCl3水解,生成HCl气体易挥发促进平衡的正向移动,生成Al(OH)3,最终受热Al(OH)3分解生成Al2O3。(5)氯化亚铁易被氧化,且水解显酸性,因此若要保存氯化亚铁溶液,应向溶液中加入Fe和HCl。
Al(OH)3+3HCl,水解吸热,加热促进AlCl3水解,生成HCl气体易挥发促进平衡的正向移动,生成Al(OH)3,最终受热Al(OH)3分解生成Al2O3。(5)氯化亚铁易被氧化,且水解显酸性,因此若要保存氯化亚铁溶液,应向溶液中加入Fe和HCl。
