题目内容
20.科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式是C(s)+CO2(g)=2CO(g)△H=+172.5kJ•mol-1.
(2)用煤炭气合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g).在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如图所示.
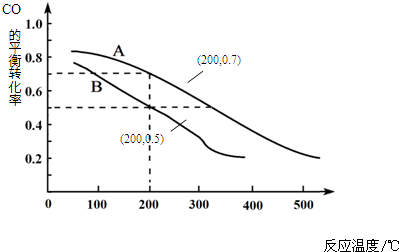
①生成甲醇的反应为放热反应(填“放热”或“吸热”).
②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是A(填“A”或“B”).
③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有降温或加压(答出一种即可).
④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.
(3)某新型电池以熔融碳酸盐作电解质,在650℃下工作,负极通入煤炭气,正极通入空气与CO2的混合气.电池的正极反应式为O2+2CO2+4e-═2CO32-,负极反应式为CO+CO32--2e-═2CO2和H2+CO32--2e-=H2O+CO2.
分析 (1)利用盖斯定律,结合已知的热化学方程式,
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1 ①
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2 kJ•mol-1 ②
①-②得到C(s)+CO2(g)=2CO(g),利用盖斯定律解答;
(2)温度升高,CO的转化率降低,说明升高温度平衡向逆反应方向移动;增大压强,平衡向正反应方向移动,则CO的转化率增大;结合图象,利用三段式法解答该题;
(3)煤炭气的主要成分为CO2和H2,在燃料电池中,负极通入燃料,正极通入氧气,熔融碳酸盐作电解质,所以正极反应式为O2+2CO2+4e-=2CO32-,负极反应式为CO+CO32--2e-=2CO2和H2+CO32--2e-=H2O+CO2.
解答 解:(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ•mol-1,
利用盖斯定律将①-②可得C(s)+CO2(g)=2CO(g)△H=+172.5 kJ•mol-1,
故答案为:C(s)+CO2(g)=2CO(g)△H=+172.5 kJ•mol-1;
(2)①由图象可知,随温度的升高其转化率降低,说明升温时平衡逆向移动,正反应放热,
故答案为:放热;
②从方程式可知,反应物有3mol气体,生成物有2mol气体,所以压强增大时平衡气体体积减小的方向移动,即正向移动,在200℃时,转化率高的压强大,
故答案为:A;
③增大反应物的转化率,即要使平衡向正向移动,而影响平衡移动的因素只有三个,温度、压强、浓度,本题只能是降温或加压,
故答案为:降温或加压;
④设加入COamol,则有H22amol
CO(g)+2H2(g)?CH3OH(g).
反应前(mol) a 2a 0
反应了(mol) 0.5a a 0.5a
平衡时(mol) 0.5a a 0.5a
可求得:$\frac{0.5a}{0.5a+a+0.5a}$×100%=25%
故答案为:25%.
(3)煤炭气的主要成分为CO2和H2,在燃料电池中,负极通入燃料,正极通入氧气,熔融碳酸盐作电解质,所以正极反应式为O2+2CO2+4e-=2CO32-,负极反应式为CO+CO32--2e-=2CO2和H2+CO32--2e-=H2O+CO2.故答案为:H2+CO32--2e-=H2O+CO2.
点评 本题考查了热化学方程式和盖斯定律的计算应用,影响平衡的因素分析判断以及原电池的工作原理知识,化学平衡移动原理是解题关键,题目难度中等,考查了学生的识图能力以及基础知识灵活运用的能力.

| A. | 用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL | |
| B. | 用托盘天平称得25.20g NaCl | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用10mL量筒量取7.13mL稀盐酸 |
| A. | 玻璃棒 | B. | 250mL容量瓶 | C. | 胶头滴管 | D. | 分液漏斗 |
| A. | 铬元素的化合价为+7价 | B. | 在检查时重铬酸钾发生氧化反应 | ||
| C. | 重铬酸钾具有强氧化性 | D. | 它由橙红色变为绿色是物理变化 |
| A. | 碳酸钠溶液与稀盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| B. | 氧化镁中加稀盐酸:2H++MgO═H2O+Mg2+ | |
| C. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| D. | 氢氧化钡溶液与硫酸溶液混合 Ba2++SO42-═BaSO4 |
| A. | 所需KCl和NH4Cl的质量分别为:74.5g和428g | |
| B. | 所配营养液K+的物质的量浓度为8 mol/L | |
| C. | 若用1000mL的容量瓶配制,定容时俯视刻度线,所配营养液浓度偏低 | |
| D. | 所用的容量瓶除检查是否漏水外,容量瓶要保持干燥 |