题目内容
【题目】在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0。第2 min时只改变一个条件,反应情况如下表:
CH3OH(g) ΔH<0。第2 min时只改变一个条件,反应情况如下表:
时间 | c(CO)/mol/L | c(H2)/mol/L | c(CH3OH)/mol/L |
起始 | 1 | 3 | 0 |
第2 min | 0.8 | 2.6 | 0.2 |
第4 min | 0.4 | 1.8 | 0.6 |
第6 min | 0.4 | 1.8 | 0.6 |
下列说法不正确的是( )
A. 第4 min至第6 min该化学反应处于平衡状态
B. 第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
C. 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D. 第6 min时,其他条件不变,如果升高温度,正反应速率增大
【答案】B
【解析】试题分析:A、第4min至第6min各物质的浓度保持不变,s所以是平衡状态,故A正确;B、第2min至第4min,反应速率加快,降低温度反应速率减慢,所以改变的条件不可能是降低温度,故B错误;C、加入催化剂会加快反应速率,第2min时,如果只改变某一条件,则改变的条件可能是使用催化剂,故C正确;D、升高温度会加快反应速率;所以第6min时,其他条件不变,如果升高温度,正反应速率增大,故D正确;故选B。

【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
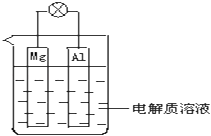
【题目】某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象.请帮助该同学整理并完成实验报告.
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
(1)实验目的:研究同周期元素性质递变规律.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
实验内容 | ① | ② | ③ | ④ |
实验现象(填A~D) |
(3)写出实验①和④对应化学方程式 实验① ,
实验④ .
(4)实验结论: .