题目内容
【题目】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。其中一种流程如下:
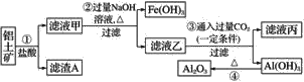
(1)写出步骤②③④中所发生主要反应的化学方程式。
步骤②____;
步骤③____;
步骤④____。
(2)若向滤渣A与适量氢氧化钠溶液反应后的混合物中通入适量二氧化碳气体,则产生的现象为___,对应的离子方程式为___。
【答案】AlCl3+4NaOH=3NaCl+NaAlO2+2H2O、FeCl3+3NaOH=Fe(OH)3↓+3NaCl CO2+NaAlO2+2H2O═Al(OH)3↓+NaHCO3 2Al(OH)3![]() Al2O3+3H2O 生成白色胶状沉淀 SiO32-+H2O+CO2=CO32-+H2SiO3↓
Al2O3+3H2O 生成白色胶状沉淀 SiO32-+H2O+CO2=CO32-+H2SiO3↓
【解析】
铝土矿加过量盐酸溶解,Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:Fe2O3+6HCl=2FeCl3 +3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,所以滤渣A为不溶物SiO2;滤液甲中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子、铝离子和氢氧化钠反应生成氢氧化铁、氢氧化铝沉淀,生成的氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以沉淀的成分是氢氧化铁;滤液乙中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,氢氧化铝沉淀加热可以得到氧化铝,即2Al(OH)3![]() Al2O3+3H2O,据此分析解题。
Al2O3+3H2O,据此分析解题。
(1)滤液甲中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子、铝离子和氢氧化钠反应生成氢氧化铁沉淀、氢氧化铝,生成的氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,步骤②中发生的主要反应有:AlCl3+4NaOH=3NaCl+NaAlO2+2H2O、FeCl3+3NaOH=Fe(OH)3↓+3NaCl;滤液乙中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,步骤③发生的反应为;CO2+NaAlO2+2H2O═Al(OH)3↓+NaHCO3;氢氧化铝沉淀加热可以得到氧化铝,步骤④发生的反应为:2Al(OH)3![]() Al2O3+3H2O,
Al2O3+3H2O,
故答案为:AlCl3+4NaOH=3NaCl+NaAlO2+2H2O、FeCl3+3NaOH=Fe(OH)3↓+3NaCl;CO2+NaAlO2+2H2O═Al(OH)3↓+NaHCO3;2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(2)滤渣A为不溶物SiO2,与适量氢氧化钠溶液反应生成硅酸钠,向其中通入适量二氧化碳气体,产生的现象白色沉淀,对应的离子方程式为SiO32-+H2O+CO2=CO32-+H2SiO3↓,
故答案为:SiO32-+H2O+CO2=CO32-+H2SiO3↓。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案