题目内容
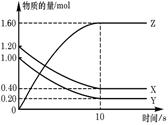
T℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
转化率小于80%

A.T℃时,该反应的化学方程式为:X(g)+Y(g) 2Z(g),平衡常数K=4 2Z(g),平衡常数K=4 |
| B.平衡时X、Y的转化率相同 |
| C.达到平衡后,恒温将容器体积扩大为3 L,平衡向逆反应方向移动 |
| D.T ℃时,若起始时X为0.60mol,Y为1.00 mol,则平衡时Y的 |
D
由图像可知反应在10s时达到化学平衡,此时XY分别减少了0.8mol、0.8mol,Z增加了1.6mol,所以反应的化学方程式为:X(g)+Y(g) 2Z(g),平衡常数
2Z(g),平衡常数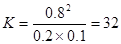 ,A不正确。平衡时X、Y的转化率分别为66.7%和80%,B不正确。由于反应前后体积不变,改变压强平衡不移动,C不正确。D相当于降低了X的浓度,即平衡向逆反应方向移动,所以会降低Y的转化率,D正确。
,A不正确。平衡时X、Y的转化率分别为66.7%和80%,B不正确。由于反应前后体积不变,改变压强平衡不移动,C不正确。D相当于降低了X的浓度,即平衡向逆反应方向移动,所以会降低Y的转化率,D正确。
 2Z(g),平衡常数
2Z(g),平衡常数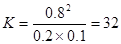 ,A不正确。平衡时X、Y的转化率分别为66.7%和80%,B不正确。由于反应前后体积不变,改变压强平衡不移动,C不正确。D相当于降低了X的浓度,即平衡向逆反应方向移动,所以会降低Y的转化率,D正确。
,A不正确。平衡时X、Y的转化率分别为66.7%和80%,B不正确。由于反应前后体积不变,改变压强平衡不移动,C不正确。D相当于降低了X的浓度,即平衡向逆反应方向移动,所以会降低Y的转化率,D正确。
练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
 2NO2(g)⊿H = +57KJ/mol,在温度为
2NO2(g)⊿H = +57KJ/mol,在温度为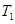 、
、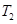 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )
时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )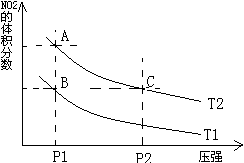
 C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是 pC(g)+qD(g),当m、n、p、q为任意正整数时,该可逆反应一定达到平衡状态的标志是:①体系的压强不再发生变化②体系的温度不再发生变化③A的转化率不再改变④各组分的百分含量不再改变⑤反应速率vA:vB:vC:vD=m:n:p:q。其中正确的是( )
pC(g)+qD(g),当m、n、p、q为任意正整数时,该可逆反应一定达到平衡状态的标志是:①体系的压强不再发生变化②体系的温度不再发生变化③A的转化率不再改变④各组分的百分含量不再改变⑤反应速率vA:vB:vC:vD=m:n:p:q。其中正确的是( ) 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( ) B(g) + xC(g),反应达平衡时,测得容器内压强增大为P%,若此时A的转化率为a%,下列关系正确的是( )
B(g) + xC(g),反应达平衡时,测得容器内压强增大为P%,若此时A的转化率为a%,下列关系正确的是( ) 2Z(g) ΔH=-a kJ·mol–1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为W mol·L–1,放出热量b kJ。
2Z(g) ΔH=-a kJ·mol–1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为W mol·L–1,放出热量b kJ。