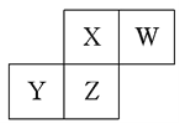
题目内容
【题目】用CO合成甲醇的化学方程式为:CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
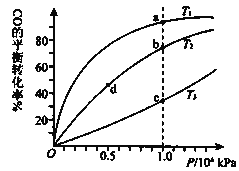
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量M(a)<M(c) M(b)>M(d)
【答案】C
【解析】
A. 反应是放热反应,同一压强下,从c点到a点,CO转化率增大,反应正向移动,说明是降温过程,因此T3>T2>T1,故A错误;
B. b、d两点的温度相同,但b点的压强大于d点,故υ(b)> υ(d),a、c两点的压强相同,根据A选项的分析得到c点的温度高,则υ(a)<υ (c),故B错误;
C. 该反应的正反应为放热反应,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,根据A选项得到T3>T2>T1,b、d温度相同,所以平衡常数相同,即K(b)=K(d);温度T3>T1,温度越高,该反应的平衡常数越小,所以K(a)>K(c),故C正确;
D. CO转化率的越大,n(总)越小,由![]() 可知,a、c点中a点n(总)小,则M(a) > M(c),b、d点中b点n(总)小,M(b)>M(d),故D错误。
可知,a、c点中a点n(总)小,则M(a) > M(c),b、d点中b点n(总)小,M(b)>M(d),故D错误。
综上所述,答案为C。

 阅读快车系列答案
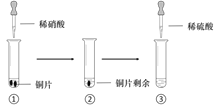
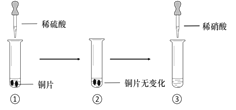
阅读快车系列答案【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O