题目内容
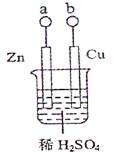
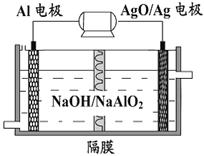
某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
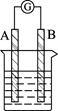
分析上述数据,回答下列问题:
(1)实验1中由A极流向B极的是 (填“电流”或“电子”);
(2)实验4中电子由B极流向A极,表明负极是 电极(填“镁”或“铝”);电极反应式为: ;
(3)实验3表明 (选填序号);
①铜在潮湿空气中不会被腐蚀 ②铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是 (选填序号)。
①相对活泼的金属一定做负极
②失去电子的电极是负极
③烧杯中的液体,必须是电解质溶液
④浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种能导电的非金属)

| 序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Zn | 稀硫酸 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验1中由A极流向B极的是 (填“电流”或“电子”);
(2)实验4中电子由B极流向A极,表明负极是 电极(填“镁”或“铝”);电极反应式为: ;
(3)实验3表明 (选填序号);
①铜在潮湿空气中不会被腐蚀 ②铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是 (选填序号)。
①相对活泼的金属一定做负极
②失去电子的电极是负极
③烧杯中的液体,必须是电解质溶液
④浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种能导电的非金属)
(1)电子 ; (2)铝 ;Al-3e-+4OH- = AlO2-+2H2O ; (3)② ; (4)①
试题分析:(1)实验1中Zn比铜活泼,铜与稀硫酸不反应,所以锌应为原电池的负极,Cu为正极,电流从正极流向负极,即从B极流向A极,所以由A极流向B极的是电子。
(2)实验4中电子由B极流向A极,表明负极是铝。这是由于Al可与NaOH溶液反应而Mg不反应,所以形成原电池时Al为负极,Mg为正极,负极反应式为Al-3e-+4OH- = AlO2-+2H2O。
(3)实验3中指针发生偏转,说明构成了原电池。铜是金属,碳棒是能导电的非金属,这说明铜在潮湿的空气中易发生电化学腐蚀,为自发的氧化还原反应,故答案选②。
(4)①相对活泼的金属不一定做负极,如实验4中电子由B极流向A极,Al为负极,故①错误;②负极发生氧化反应,因此失去电子的电极是负极,故②正确;③烧杯中的液体,必须是电解质溶液,原电池工作时溶液中通过离子的定向移动形成闭合回路,故③正确;④形成原电池的两极应是活泼性不同的两种金属或金属与非金属,可形成电势差而形成电流,故④正确,答案选①。

练习册系列答案
相关题目



 Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )