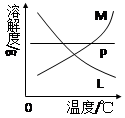题目内容
(12分)在实验室里可用下图所示装置(夹持装置末画出)制取氯酸钾、次氯酸钾和探究氯水的性质。
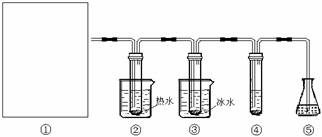
图中:①为氯气发生装置;②试管里盛有15mL 30%KOH溶液,并置于水浴中;③试管里盛有15mL 8% KOH溶液,并置于冰水浴中;④试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)在答题卡方框中画出二氧化锰和浓盐酸制取氯气的装置图(铁架台和加热装置可不画出)
(2)制取氯气时,向烧瓶中加入适量浓盐酸的操作是 。
(3)比较制取氯酸钾和次氯酸钾的条件,二者的差异是: 。
![]()
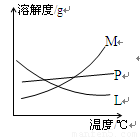
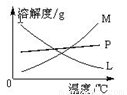
 反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验名称)。
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验名称)。
(4)本实验中制取氯酸钾的离子方程式是 。
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 | 原因 |
溶液初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 |
|
然后溶液从无色逐渐变为 色 |
|
(1)![]() (2分)
(2分)
(2)先打开分液漏斗上面的塞子,再打开分液漏斗的旋塞,使浓盐酸滴入烧瓶中。(1分)
(3)碱溶液(或反应物)的浓度不同,反应温度不同;M:过滤。(各1分)
(4)3Cl2+6OH-=ClO3-+5Cl-+3H2O(2分)
(5)(各1分)
红 |
|
| 氯气与水反应生成HclO将石蕊氧化为无色物质 |
黄绿 | 继续通入的氯气溶于水使溶液呈黄绿色 |

(共16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:____________________________。
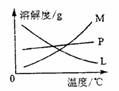
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是______________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________ |
| 然后溶液从无色逐渐变为_______色 | _______________________________ |
(共16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
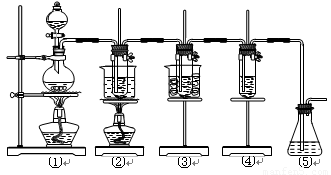
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:____________________________。
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是______________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为_______色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
_______________________________ |
|
然后溶液从无色逐渐变为_______色 |
_______________________________ |
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
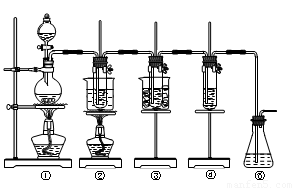
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊
试液;⑤为尾气吸收装置。
请填写下列空白:
⑴ 制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸
⑵ 如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因:
①_______________________________________________,
②__________________________________________________________________________。
⑶ 比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ;
② 。
反应完毕经冷却后,②的试管中有大量晶体析出。下图
中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
⑷ 实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为_______色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
______________________________________ |
|
然后溶液从无色逐渐变为_______色 |
______________________________________ |