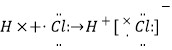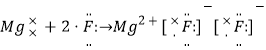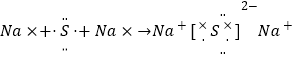题目内容
【题目】印刷电路板在科技领域具有不可替代的作用,它的制备方法为高分子化合物和铜箔压合,通过FeCl3溶液“腐蚀”而成。某实验小组在实验室用废弃的印刷电路板和“腐蚀液”提取铜的一种工艺流程如下:
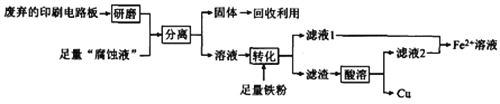
请回答下列问题:
(1)检验“腐蚀液”中含有Fe3+的方法为_____________________________。
(2)“分离”所用的操作名称为________ 。该操作所用的主要玻璃仪器除了有烧杯还有_______。
(3)Fe2+溶液有很多重要用途。
①已知:常温下Ksp[Fe(OH)2]=1.8×10-16。保存1.8mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊,应调节溶液的pH不超过_______________。
②Fe2+转化为Fe3+后,可用于制备高铁酸盐。向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为____________________________________________。
③一定温度下,向0.1 molL-1的Fe(NO3)2溶液中加入AgNO3 固体忽略溶液体积的变化,平衡c(Fe3+)与c(Ag+)的关系如图所示:Fe2++Ag+![]() Fe3++Ag
Fe3++Ag
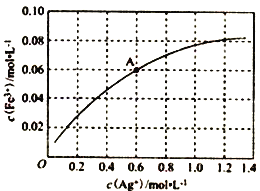
该温度下,A 点溶液中以上反应的化学平衡常数为__________(溶液体积变化忽略不计);若将0.6 molL-1Fe(NO3)2溶液、0.15 molL-1Fe(NO3)3溶液、0.06molL-1AgNO3溶液等体积混合后,再加入1.08gAg,可观察到的现象为_________________________________。
【答案】 取少量“腐蚀液”于洁净的试管中,滴加KSCN溶液,溶液呈血红色 过滤 漏斗、玻璃棒 6 2FeCl3+3NaClO+l0NaOH===2Na2FeO4 +9NaCl+5H2O 2.5 Ag部分溶解,溶液黄色变浅
【解析】(1)检验“腐蚀液”中含有Fe3+的方法是取少量“腐蚀液”于洁净的试管中,滴加KSCN溶液少许,溶液呈血红色(或滴加苯酚溶液少许,溶液呈紫色);
(2)“分离”是将固体和液体分离,所以用过虑;过虑所用的主要玻璃仪器有烧杯、漏斗、玻璃棒等,
(3) ①已知常温下Ksp[Fe(OH)2]=1.8×10-16,要确保1.8mol·L-1的FeSO4溶液中不出现浑浊,则c(OH-)<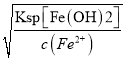 =
=![]() =1.0×10-8mol/L,所以pH<6;②向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为2FeCl3+3NaClO+l0NaOH===2Na2FeO4 +9NaCl+5H2O;③图象中的A点对应的c(Ag+)=0.6mol/L,c(Fe3+)=0.06mol/L,由化学平衡Fe2++Ag+
=1.0×10-8mol/L,所以pH<6;②向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为2FeCl3+3NaClO+l0NaOH===2Na2FeO4 +9NaCl+5H2O;③图象中的A点对应的c(Ag+)=0.6mol/L,c(Fe3+)=0.06mol/L,由化学平衡Fe2++Ag+![]() Fe3++Ag可得平衡常数K=
Fe3++Ag可得平衡常数K= 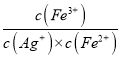 =
= ![]() = 2.5(mol/L)-1;若将0.6 molL-1Fe(NO3)2 溶液、0.15 molL-1Fe(NO3)3 溶液、0.06 molL-1AgNO3溶液等体积混合,混合后溶液中c(Fe2+)=0.2mol/L,c(Fe3+)=0.05mol/L,c(Ag+)=0.02mol/L,则Q=
= 2.5(mol/L)-1;若将0.6 molL-1Fe(NO3)2 溶液、0.15 molL-1Fe(NO3)3 溶液、0.06 molL-1AgNO3溶液等体积混合,混合后溶液中c(Fe2+)=0.2mol/L,c(Fe3+)=0.05mol/L,c(Ag+)=0.02mol/L,则Q= 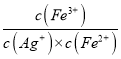 =
= ![]() =12.5(mol/L)-1>K=2.5(mol/L)-1,所以平衡逆向移动,因此有部分银溶解,溶液的黄色变浅。
=12.5(mol/L)-1>K=2.5(mol/L)-1,所以平衡逆向移动,因此有部分银溶解,溶液的黄色变浅。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案