题目内容
【题目】100mL浓度为2mol.L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A. 加入适量6 mol.L-1的盐酸
B. 加入少量醋酸钠固体
C. 加热
D. 加入少量金属钠
【答案】C
【解析】试题分析:A.加入适量的6 molL-1的盐酸,反应速率加快,生成氢气增多,故A不选;B.加入少量醋酸钠固体,生成醋酸,氢离子浓度变小,反应速率减慢,故B不选;C.升高温度,反应速率增大,生成氢气的总量不变,故C选;D.加入钠,与水反应生成氢气,氢气的总量改变,故D不选;故选C。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】二氧化硫是一种重要的化工原料,主要用于生产硫酸、亚硫酸盐等。请回答:
(1)已知2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。

①T1__________(填“>”“<”或“=”)T2,判断的依据是_____________________;该反应为____________(填“放”或“吸”)热反应,判断的依据是___________________。
②下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。
投料比 | a | b | c | d |
SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
i.b对应的投料比为_____________。
ii.投料比为8:10时,平衡混合气体中SO3体积分数为_________________。
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:

①吸收池中发生反应的离子方程式是_____________________。
②电解池的构造示意图如下:
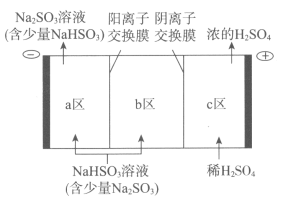
i.在图中标示出b区的Na+和HSO3-的移动方向。
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:__________________。


