题目内容
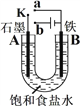
【题目】I、某研究小组探究SO2和Fe(NO3)3溶液的反应。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,铁架台等夹持仪器已略去,请回答:
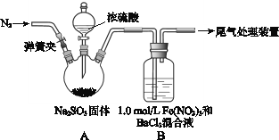
(1)装置A中发生的化学方程式为________________。
(2)滴加浓硫酸之前要先打开弹簧夹通入一定量的N2,其目的是___________。
(3)实验中,装置B中产生了白色沉淀,该沉淀的成分是____,说明SO2具有______性。
(4)分析B中产生白色沉淀的原因:
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
基于观点1,装置B中反应的离子方程式是______________,为证明该观点,应进一步检验生成的新物质,其实验操作及现象为(假定在反应中SO2的量不足)________。
基于观点2,只需将装置B中Fe(NO3)3溶液替换为等体积的下列溶液,在相同的条件下进行实验。应选择的最佳试剂是____(填序号)。
A. 0.1 mol·L-1的稀硝酸
B. 1.5 mol·L-1的Fe(NO3)3溶液
C、6.0 mol·L-1的NaNO3和0.2 mol·L-1盐酸等体积混合的混合液
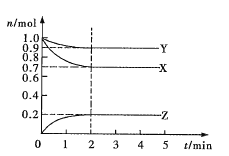
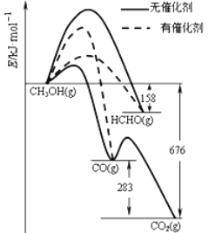
II、(1)人们常用催化剂来选择反应进行的方向.图1所示为一定条件下1 mol CH3OH与O2发生反应时生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成________(填“CO”、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
【答案】Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 排净装置中的空气,为排除氧气对实验的干扰 BaSO4 还原性 SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+ 取少量B中溶液于试管中,加入少量[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点1合理 C HCHO -470kJ/mol
【解析】
I、(1)亚硫酸钠和浓硫酸反应生成二氧化硫和硫酸钠;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;
(4)Fe3+和NO3-都具有氧化性,都可与二氧化硫反应,可根据反应产物进行判断。
II、(1)使用催化剂可以降低反应的活化能;
根据图表可知2HCHO(g)+O2(g)=2CO(g)+2H2O(g)中反应物能量高,生成物能量低,该反应为放热反应,然后依据图中给出数据解答。
(l)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;
(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;
(4)①按观点1,装置B中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,可通过检验是否有Fe2+生成的方法判断,具体做法为取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点1合理;
②观点2是在酸性条件下SO2与NO3-反应,实验中c(NO3-)=3mol/L,则可用6.0molL-1NaNO3和0.2molL-1盐酸等体积混合的溶液代替,故答案为:C。
Ⅱ、(1)根据图象可以看出转化成甲醛时活化能最低,使用催化剂时主要产物为HCHO;2HCHO(g)+O2(g)=2CO(g)+2H2O(g)该反应为放热反应,△H=-2(676-158-283)KJmol-1=-470KJmol-1。

【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同的方式投入反应物,发生反应 N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
容器甲 | 容器乙 | 容器丙 | |
反应温度/℃ | 400 | 400 | 500 |
反应物投入量 | 1molN2,3molH2 | 4molNH3 | 1molN2,3molH2 |
平衡时v(正)(H2)/mol/(Ls) | v1 | v2 | v3 |
平衡时c(NH3)/(mol/L) | c1 | c2 | c3 |
平衡时总压强P/Pa | P1 | P2 | P3 |
物质的平衡转化率a | a1(N2) | a2(NH3) | a3(N2) |
平衡常数K | K1 | K2 | K3 |
下列关系正确的是
A. v1<v2,c1<2c2 B. c2>2c3,a2(NH3)+a3(N2)<1
C. K1>K3, P2>2P3 D. v1<v3,a1(N2)<a3(N2)
【题目】800℃时,在2L恒容密闭容器中投入0.20molNO和0.12mol O2发生下列反应2NO(g)+O2(g) ![]() 2NO2(g),n(NO)随时间的变化情况如下表:
2NO2(g),n(NO)随时间的变化情况如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.04 | 0.04 |
(1)800℃时,该反应平衡时的NO的物质的量浓度为______;升高温度,NO的平衡浓度为0.03molL-1,则该反应为_______反应(填“放热”或“吸热”)。
(2)用O2表示0~2s内该反应的平均反应速率v(O2)=______。
(3)能说明该反应一定达到平衡状态的是______。
a v(NO2)=2v(O2) b 容器内压强保持不变
c 容器内气体颜色保持不变 d 容器内气体密度保持不变
(4) 平衡后,下列措施能使该反应向正反应方向移动,且正反应速率增大的是____。
a 适当升高温度 b 适当降低温度
c 增大O2的浓度 d 选择高效催化剂
(5)800℃时,上述反应的平衡常数K=______,若容器中含1.00 molL-1 NO、2.00 molL-1O2和2.00 molL-1 NO2,则此时v正_______v逆 (填“>”、“<”或“=”)。