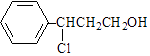题目内容
【题目】常见元素X、Y、Z 组成的四种物质甲、乙、丙、丁,它们之间能发生反应:甲+乙→丙+丁,其中甲是由X 元素和Z 元素组成的化合物,乙是由Y 元素和Z 元素组成的化合物,丙只含Z 元素。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为__________;上述反应在标准状况下生成 5.6L 丙时,转移的电子数为__________; 常温下丁溶液pH_____7(填“>”、“<”或“=”),用离子方程式解释_________________________________。
(2)若丙是淡黄色固体,不溶于水也不和水反应。则上述反应的化学方程式是__________。
【答案】 ![]() 0.5NA 或3.01×1023 > CO32-+H2OHCO3-+OH- 2H2S+SO2=3S↓+2H2O
0.5NA 或3.01×1023 > CO32-+H2OHCO3-+OH- 2H2S+SO2=3S↓+2H2O
【解析】(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体,根据反应:甲+乙→丙+丁可推断甲为过氧化钠,乙为二氧化碳,丙为氧气,丁为碳酸钠,则甲的电子式为![]() ;反应:甲+乙→丙+丁为: 2Na2O2+2CO2=2Na2CO3+O2,根据反应可知,在标准状况下生成 5.6L O2时,转移电子的物质的量为
;反应:甲+乙→丙+丁为: 2Na2O2+2CO2=2Na2CO3+O2,根据反应可知,在标准状况下生成 5.6L O2时,转移电子的物质的量为![]() ×2×1=0.5mol,则转移电子数为0.5NA 或3.01×1023;常温下Na2CO3溶液水解呈碱性CO32-+H2OHCO3-+OH-,pH>7;(2)若丙是淡黄色固体,不溶于水也不和水反应,则丙为硫单质,根据反应:甲+乙→丙+丁,其中甲是由X 元素和Z 元素组成的化合物,乙是由Y 元素和Z 元素组成的化合物,丙只含Z 元素。可推断甲为二氧化硫,乙为硫化氢,丙为硫,丁为水,反应:甲+乙→丙+丁为:2H2S+SO2=3S↓+2H2O。
×2×1=0.5mol,则转移电子数为0.5NA 或3.01×1023;常温下Na2CO3溶液水解呈碱性CO32-+H2OHCO3-+OH-,pH>7;(2)若丙是淡黄色固体,不溶于水也不和水反应,则丙为硫单质,根据反应:甲+乙→丙+丁,其中甲是由X 元素和Z 元素组成的化合物,乙是由Y 元素和Z 元素组成的化合物,丙只含Z 元素。可推断甲为二氧化硫,乙为硫化氢,丙为硫,丁为水,反应:甲+乙→丙+丁为:2H2S+SO2=3S↓+2H2O。

【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 |
|
| ||||||
三 |
|
|
|
|
|
| ||
四 |
(1)9种元素中,化学性质最不活泼的是______,原子结构示意图为____________。
(2)这些元素中,最高价氧化物的水化物中碱性最强的碱是__________,写出元素![]() 的单质与其反应的离子方程式:___________________________________。
的单质与其反应的离子方程式:___________________________________。
(3)最高价氧化物是两性氧化物的元素是______ ,写出它的氧化物与NaOH溶液反应的化学反应方程式: ____________________________________ 。
(4)用电子式表示元素![]() 和
和![]() 组成的化合物的形成过程 _____________________________,该化合物属于 ______ (填“共价”或“离子”
组成的化合物的形成过程 _____________________________,该化合物属于 ______ (填“共价”或“离子”![]() 化合物。
化合物。
【题目】有关键能数据如表:
化学键 | Si﹣O | O=O | Si﹣Si |
键能/kJmol﹣1 | X | 498.8 | 176 |
晶体硅的燃烧热为989.2kJmol﹣1 , 则X的值为( )
A.423.3
B.460
C.832
D.920