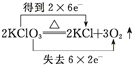
题目内容
【题目】下列说法正确的是
A.一定条件下,增大反应物的量会加快化学反应速率
B.增大压强,肯定会加快化学反应速率
C.活化分子间所发生的碰撞为有效碰撞
D.升高温度,无论吸热还是放热反应,V正、V逆均增大
【答案】D
【解析】
A.若反应物是固体或纯液体,则一定条件下,增大反应物的量不会加快化学反应速率,A错误;
B.对于无气体参加的反应,增大压强,化学反应速率不变,B错误;
C.能够发生化学反应的碰撞为有效碰撞,活化分子间所发生的碰撞不一定发生化学反应,因此不一定为有效碰撞,C错误;
D.升高温度,无论吸热还是放热反应,物质分子含有的能量增加,有效碰撞次数增多,化学反应速率加快,所以V正、V逆均增大,D正确;
故合理选项是D。

练习册系列答案
相关题目
【题目】一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
(1)用NO2表示0~2 s内该反应的平均速度___________.在第5 s时,NO2的转化率为_____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是_____________________。
(2)上述反应在第3 s后达到平衡,能说明该反应已达到平衡状态的是______。
a.单位时间内,消耗2 mol NO2的同时生成1 mol的N2O4
b.容器内压强保持不变
c.v逆(NO2)=2v正(N2O4)
d.容器内密度保持不变
(3)在2 s内,该反应_______(“吸收”或“放出”) _______热量。