题目内容
(10分)
|
A |
|
|
|||||||||||||||||||||||
|
B |
|
|
|
C |
D |
E |
F |
|
|||||||||||||||||
|
G |
|
H |
|
|
|
I |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
(1)在上面元素周期表中全部是金属元素的区域为___________。
A.a B.b C.c D.d
(2)G元素单质在E元素单质中燃烧时形成的化合物的化学式是______,它是__________(填“共价化合物”或“离子化合物”)。该化合物含有的化学键类型是 ;
该化合物的电子式是 。
(3)表格中九种元素能形成最高价氧化物对应的水化物中,碱性最强的是________(用化合物的化学式表示,下同),酸性最强的是__________,属于两性氢氧化物的是__________。
(4)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 ________(填名称),可以验证该结论的实验是_______。(填编号)
a将在空气中放置已久的这两种元素的块状单质分别放入热水中;
b将这两种元素的单质粉末分别和同浓度的盐酸反应;
c将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液;
d比较这两种元素的气态氢化物的稳定性。
(1)B(1分)
(2)
Na2O2,离子化合物 离子键和非极性键(或共价键);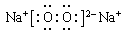 (3分)
(3分)
(3) NaOH, HClO4, Al(OH)3。(3分) (4) ①(1分)② 镁, (1分) bc。(1分)
【解析】考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知A~I分别是H、Li、C、N、O、F、Na、Al、Cl。
(1)过渡元素全部属于金属元素,所以答案选B。
(2)钠在氧气的燃烧产物是过氧化钠,含有离子键和非极性键,电子式为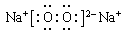 。
。
(3)金属性越强,最高价氧化物的水化物的碱性越强;非金属性越强,最高价氧化物的水化物的酸性越强,所以氢氧化钠的碱性最强,HClO4的酸性最强,Al(OH)3属于两性氢氧化物。
(4)常温下在浓硫酸中发生钝化的短周期元素是铝,则甲是铝,位于第三周期第ⅢA。乙元素原子核外M电子层与K电子层上的电子数相等,所以乙是镁,位于第三周期第ⅡA。同周期自左向右金属性逐渐增强,所以金属性强的是镁。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数例外)。
6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。
7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
所以据此可知选项bc正确。

(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42— HCO3— NO3— OH— |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生
白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1molA的溶液与含1molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
(10分)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
|
阳离子 |
Na+、Ba2+、NH4+ |
|
阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ ,C是_______ ,D是________ 。
(2)用离子方程式表示A的水溶液显碱性的原因________________________________。
(3)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为____________ _______。
 M(OH)2
M(OH)2 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C.
 E.
E.