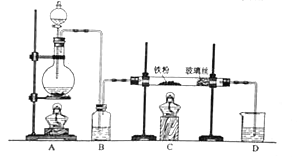
题目内容
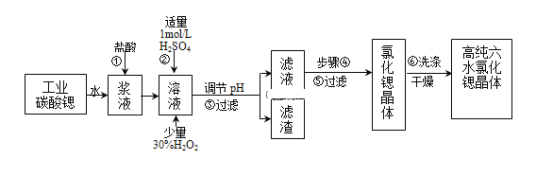
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl26H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①需要加快反应速率,措施有充分搅拌和______(写一种).碳酸锶与盐酸反应的离子方程式______.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至______;宜用的试剂为______.
A.1.5B.3.7C.9.7D.氨水E.氢氧化锶粉末F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是______(填化学式).
(4)工业上用热风吹干六水氯化锶,适宜的温度是______
A.50~60℃B.80~100℃C.100℃以上
【答案】加热、 适当增加盐酸浓度等 SrCO3+2H+=Sr2++CO2↑+H2O B E Fe(OH)3、BaSO4 A
【解析】
根据题目流程信息推断化学反应流程原理;根据外界条件对化学反应速率的影响分析解答。
以SrCO3为原料制备六水氯化锶(SrCl26H2O)由流程可知,SrCO3和盐酸发生反应:SrCO3+2HCl=SrCl2+CO2↑+H2O,反应后溶液中除含有Sr2+和Cl外,还含有少量Fe2+、Ba2+杂质,加入过氧化氢将Fe2+氧化为Fe3+,然后加硫酸生成硫酸钡沉淀,同时调节溶液pH,使Fe3+转化氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2,最后蒸发浓缩、冷却结晶得到SrCl26H2O。
(1) 操作①需要加快反应速率,根据影响化学反应速率的因素分析,可行的措施有:充分搅拌、加热或适当增大盐酸的浓度。碳酸锶与盐酸反应生成氯化锶、二氧化碳和水,反应方程式为:SrCO3+2HCl=SrCl2+CO2↑+H2O,即离子方程式为:SrCO3+2H+=Sr2++CO2↑+H2O,
故答案为:加热、 适当增加盐酸浓度等;SrCO3+2H+=Sr2++CO2↑+H2O;
(2)由表中数据可知,Fe3+在pH=1.5时开始沉淀,在pH=3.7时沉淀完全,故在步骤②③的过程中,将溶液的pH值由1调节至3.7,使Fe3+转化氢氧化铁沉淀,且不能引入新杂质,可以选择氢氧化锶粉末。
故答案为:B;E;
(3)加入了稀硫酸,有硫酸钡生成,加入过氧化氢,将Fe2+氧化为Fe3+,再调节溶液pH,水解可生成氢氧化铁沉淀,操作③中所得滤渣的主要成分是BaSO4、Fe(OH)3 。
故答案为:Fe(OH)3、BaSO4;
(4)六水氯化锶晶体61℃时开始失去结晶水,100℃时失去全部结晶水,则用热风吹干六水氯化锶,选择的适宜温度范围是5060℃。
故答案为:A。