题目内容
下列说法正确的是( )。
| A.Li是最活泼金属,F是最活泼非金属 |
| B.Mg(OH)2碱性比Ca(OH)2强 |
| C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 |
D.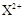 的核外电子数目为18,则X在第四周期第ⅡA族 的核外电子数目为18,则X在第四周期第ⅡA族 |
D
解析

练习册系列答案
相关题目
下列粒子半径之比小于1的是( )。
| A.r (Na+)/ r (Na) | B.r (Cl-)/ r (Cl) | C.r (Na)/ r (Mg) | D.r (Ca)/ r (Mg) |
X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
| A.HX | B.H2X | C.XH4 | D.XH3 |
下列粒子中,与NH4+具有相同质子数和电子数的是
| A.OH— | B.F- | C.Na+ | D.NH3 |
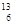 C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关
C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关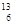 C的说法正确的是( )
C的说法正确的是( )
| A.质子数为6 | B.电子数为13 |
| C.中子数为6 | D.质量数为6 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是( )
| A.气态氢化物稳定性:X > Y |
| B.元素非金属性:W >Y |
| C.原子半径的大小顺序为:r(Z)>r(W)>r(Q) |
| D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与NaOH溶液反应 |
下列事实不能说明Cl原子的得电子能力比S原子强的是( )
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.②⑤ | B.①② | C.①②④ | D.①③⑤ |
第二周期元素R,它的最外电子层达到稳定结构所需电子数小于最外层达到稳定结构时的电子数和最内层电子数之差,并且等于最内层电子数的整数倍。则关于R的正确说法是( )。
| A.常温下能稳定存在的R的氧化物都能和烧碱溶液起反应 |
| B.R最高价氧化物对应水化物都是强酸 |
| C.R的最简单氢化物可能有两种,其稳定性一种比NH3强,另一种比NH3弱 |
| D.R的最简单氢化物受热时都易分解 |
下列说法正确的是( )。
| A.所有原子都是由质子、中子和核外电子构成的 |
| B.只要知道粒子的质子数,就一定能确定它是什么元素 |
| C.由于质量数=质子数+中子数,所以,电子是没有质量的 |
| D.分子的质子数等于该分子中各原子质子数之和 |