题目内容
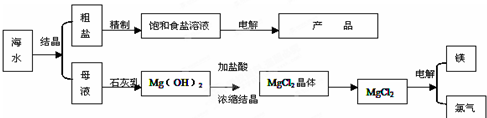
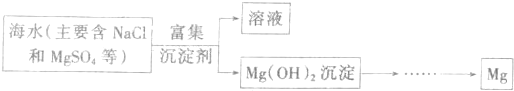
海水的综合利用可以制备金属镁,其流程如图所示:
(1)实验室里将粗盐制成精盐的过程中溶解、过滤、蒸发三个步骤的操作中都要用到一种仪器是______在过滤操作中使用该仪器的作用是______.
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤.______
(3)写出由MgCl2制得Mg的相应反应的化学方程式______.

(1)实验室里将粗盐制成精盐的过程中溶解、过滤、蒸发三个步骤的操作中都要用到一种仪器是______在过滤操作中使用该仪器的作用是______.
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤.______
(3)写出由MgCl2制得Mg的相应反应的化学方程式______.
海水蒸发得到粗盐和母液,向母液中加入CaO,发生的反应为:CaO+H2O=Ca(OH)2、Mg2++2OH-=Mg(OH)2↓,向氢氧化镁中加入盐酸发生反应Mg(OH)2+2HCl=MgCl2+2H2O,将氯化镁溶液浓缩得到MgCl2.6H2O,将MgCl2.6H2O在HCl氛围中脱水得到MgCl2,电解熔融MgCl2得到Mg单质,将粗盐溶于水进行重结晶得到精盐.
(1)实验室里将粗盐制成精盐的过程中溶解、过滤、蒸发三个步骤的操作中都要用到一种仪器是玻璃棒,在溶解、蒸发过程中玻璃棒起搅拌作用,在过滤过程中玻璃棒起引流作用,
故答案为:玻璃棒;引流;
(2)溶度积常数大的物质向溶度积常数小的物质转化,氢氧化钙的溶度积常数大于氢氧化镁,所以加入氯化镁溶液,充分搅拌,过滤,沉淀用水洗涤得到氢氧化镁固体,故答案为:加入氯化镁溶液,充分搅拌,过滤,沉淀用水洗涤;
(3)镁是活泼金属,工业上用电解熔融氯化镁的方法冶炼镁,方程式为MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑.
(1)实验室里将粗盐制成精盐的过程中溶解、过滤、蒸发三个步骤的操作中都要用到一种仪器是玻璃棒,在溶解、蒸发过程中玻璃棒起搅拌作用,在过滤过程中玻璃棒起引流作用,
故答案为:玻璃棒;引流;
(2)溶度积常数大的物质向溶度积常数小的物质转化,氢氧化钙的溶度积常数大于氢氧化镁,所以加入氯化镁溶液,充分搅拌,过滤,沉淀用水洗涤得到氢氧化镁固体,故答案为:加入氯化镁溶液,充分搅拌,过滤,沉淀用水洗涤;
(3)镁是活泼金属,工业上用电解熔融氯化镁的方法冶炼镁,方程式为MgCl2(熔融)
| ||
| ||

练习册系列答案
相关题目
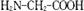 )和丙氨酸(
)和丙氨酸(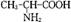 )缩合最多可形成4种二肽
)缩合最多可形成4种二肽