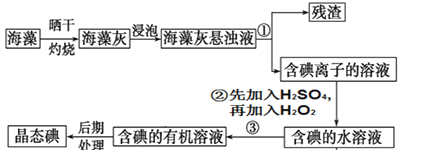
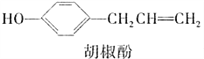
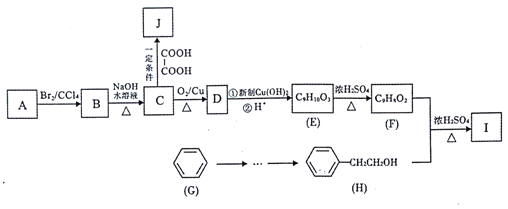
题目内容
【题目】甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是( )
A. 参加反应的H2SO4为0.2mol B. 参加反应的NaOH约为0.27mol
C. 加入铝粉的质量A=5.4 D. 与硫酸反应的铝粉的质量7.2g
【答案】B
【解析】
试题如果铝完全反应则生成的氢气体积是相等的,但由于反应结束后生成的氢气体积为甲:乙=3:4,这说明铝与稀硫酸反应时硫酸不足,铝过量。与氢氧化钠溶液反应时铝完全反应,氢氧化钠过量或恰好反应。A、硫酸的物质的量=0.1L×3mol/L=0.3mol,即参加反应的硫酸是0.3mol,A不正确;B、硫酸生成的氢气是0.3mol,所以氢氧化钠与铝反应生成的氢气是0.4mol,则根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,参加反应的氢氧化钠是![]() ×2=0.27mol,B正确;C、根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,参加反应的铝的物质的量=
×2=0.27mol,B正确;C、根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,参加反应的铝的物质的量=![]() ×2,质量=
×2,质量=![]() ×2×27g/mol=7.2g,C不正确;D、根据反应2Al+3H2SO4=Al2(SO4)3+3H2↑可知,参加反应的铝的质量=0.2mol×27g/mol=5.4g,D不正确,答案选B。
×2×27g/mol=7.2g,C不正确;D、根据反应2Al+3H2SO4=Al2(SO4)3+3H2↑可知,参加反应的铝的质量=0.2mol×27g/mol=5.4g,D不正确,答案选B。

【题目】下列实验的叙述中有错误的是
选项 | 实验操作 | 目的或结论 |
A | 向2mL滴有2滴KSCN溶液的FeI2溶液中加入几滴氯水 | 确定Fe2+、I-还原性的相对强弱 |
B | 将C2H5OH与浓H2SO4在蒸馏烧瓶中混合后加热至170℃,将从瓶内逸出的物质通入到酸性KMnO4溶液中 | 检验有无乙烯生成 |
C | 将含有CO的CO2缓慢通过灼热的CuO | 除去CO |
D | 用一定浓度的NaOH滴定一定体积、浓度的草酸(H2C2O4、弱酸)溶液(用酚酞作指示剂) | 确定草酸是二元酸 |
A. A B. B C. C D. D