题目内容
【题目】铁在工业、农业和国防科技中有重要应用,我国已是生产钢铁最多的国家。回答下列问题:
(1) 工业上以磁铁矿和焦炭为原料冶炼铁存在以下变化:
①Fe3O4(s)+4C(s)=3Fe(s)+4CO(g) ΔH1=+678kJ·mol-1 ②CO(g)+![]() O2(g)=CO2(g) ΔH2=-283kJ·mol-1
O2(g)=CO2(g) ΔH2=-283kJ·mol-1
③C(s) +![]() O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
则ΔH4=____kJ·mol-1。
(2)铁矿石中常含有硫, 使高炉尾气中混有SO2, 除去高炉尾气中SO2 的物质是___。生产中发现, 无论怎么改变原料配比与条件, 在高炉尾气中始终有CO, 原因是___。
(3)在温度 aK时,反应Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)的浓度平衡常数Kc=16(用浓度计算所得),则用分压(分压等于总压×体积分数)代替浓度算得的平衡常数Kp ___Kc(填 “大于”“小于” 或 “等于”)。平衡混合气体中CO的体积分数为___(保留两位有效数字)。
(4) aK 时,在体积为 2L 的密闭容器中,加入 Fe、 Fe3O4、 CO、 CO2各1.0mol,气体的压强为PkPa。
①此时,v 正(CO2) ___v 逆(CO)(填 “大于”“小于” 或 “等于”), 反应经过5min后达到平衡, 该时间范围内的平均反应速率 v(CO2)=___mol/(L·min)(保留两位有效数字)。
②已知:恒容条件下,相同分子数的气体,其压强与温度成正比。平衡后温度从 aK逐渐升高到3aK, 请在下图中绘制出CO分压(PCO的变化曲线)_______ 。

【答案】-14 碱液(氢氧化钠溶液或氨水等) 高温下冶炼铁的反应是可逆反应,反应有限度(或反应要达到平衡),CO始终反应不完 等于 33% 大于 0.033或3.3×10-2 
【解析】
(1)工业上以磁铁矿和焦炭为原料冶炼铁存在以下变化:①Fe3O4(s)+4C(s)=3Fe(s)+4CO(g) ΔH1=+678kJ·mol-1 ②CO(g)+![]() O2(g)=CO2(g) ΔH2=-283kJ·mol-1③C(s) +
O2(g)=CO2(g) ΔH2=-283kJ·mol-1③C(s) +![]() O2(g)=CO(g) ΔH3=-110kJ·mol-1 ,根据盖斯定律:①+②×4-③×4得:④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4则ΔH4=+678kJ·mol-1 +(-283kJ·mol-1)×4-(-110kJ·mol-1)×4=-14kJ·mol-1。
O2(g)=CO(g) ΔH3=-110kJ·mol-1 ,根据盖斯定律:①+②×4-③×4得:④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4则ΔH4=+678kJ·mol-1 +(-283kJ·mol-1)×4-(-110kJ·mol-1)×4=-14kJ·mol-1。
故答案为:-14;
(2)SO2是酸性氧化物,除去高炉尾气中SO2 的物质是碱液(氢氧化钠溶液或氨水等)。生产中发现,无论怎么改变原料配比与条件,在高炉尾气中始终有CO,原因是高温下冶炼铁的反应是可逆反应,反应有限度(或反应要达到平衡),CO始终反应不完。故答案为:碱液(氢氧化钠溶液或氨水等);高温下冶炼铁的反应是可逆反应,反应有限度(或反应要达到平衡),CO始终反应不完;
(3)在温度 aK时,反应Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)的浓度平衡常数Kc=16(,因反应前后气体的体积不变,则用分压代替浓度算得的平衡常数Kp 等于Kc。
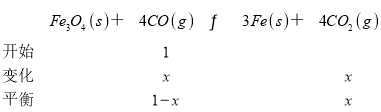
![]() =16,x=
=16,x=![]() ,平衡混合气体中CO的体积分数为
,平衡混合气体中CO的体积分数为 =30%(保留两位有效数字)。故答案为:等于;30%;
=30%(保留两位有效数字)。故答案为:等于;30%;
(4)aK 时,在体积为 2L 的密闭容器中,加入 Fe、 Fe3O4、 CO、 CO2各1.0mol,气体的压强为PkPa。
①此时,Qc=![]() =1<16=K,反应正向进行,v 正(CO2) 大于v 逆(CO), 反应经过5min后达到平衡,
=1<16=K,反应正向进行,v 正(CO2) 大于v 逆(CO), 反应经过5min后达到平衡,
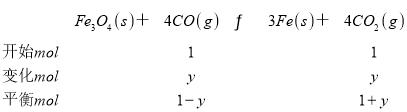
K=![]() =16,y=
=16,y=![]() mol,该时间范围内的平均反应速率 v(CO2)=
mol,该时间范围内的平均反应速率 v(CO2)=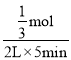 =0.033或3.3×10-2mol/(L·min)(保留两位有效数字)。故答案为:大于;0.033或3.3×10-2;
=0.033或3.3×10-2mol/(L·min)(保留两位有效数字)。故答案为:大于;0.033或3.3×10-2;
②恒容条件下,相同分子数的气体,其压强与温度成正比。平衡后温度从 aK逐渐升高到3aK,Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4=-14kJ·mol-1,反应是放热反应,升高温度平衡逆向移动,CO的物质的量增大,CO的物质的量在(![]() ,1)区间,压强在(
,1)区间,压强在(![]() p,3p)区间, CO分压(PCO的变化曲线)如图:
p,3p)区间, CO分压(PCO的变化曲线)如图: 。
。
故答案为: 。
。

 阅读快车系列答案
阅读快车系列答案