题目内容
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了 加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式 、 。
(2)甲同学设计的实验 (填能或不能)验证乙炔与溴发生加成反应,其理由是
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式是 ;在验证过程中必须将此杂质全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。

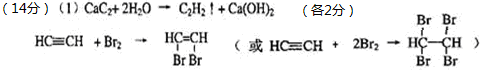
(2)不能 (1分) a、c (2分)
(3)H2S (1分) Br2+H2S=S↓+2HBr (2分)
(4) c b
(CuSO4或NaOH溶液) (CuSO4溶液) (各1分)
解析试题分析:(1)甲同学的两个反应包括制取乙炔的反应、乙炔与溴的加成反应,化学方程式为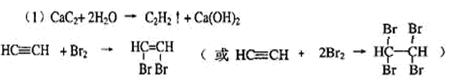
(2)甲同学的实验不能验证乙炔与溴发生加成反应,应为不能确定乙炔与溴发生的一定是加成反应,也不能确定使溴水褪色的物质一定是乙炔,实验答案选ac。
(3)制取乙炔的电石中常含有S杂质,结合褪色后的溶液里有少许淡黄色浑浊,所以乙同学推测此乙炔中必定含有的一种杂质气体是硫化氢,硫化氢与溴水反应的化学方程式为Br2+H2S=S↓+2HBr
(4)电石与水的反应很剧烈,不能用启普发生器,所以电石、水放在c装置,b装置放氢氧化钠溶液或硫酸铜溶液以除去硫化氢气体,继续选用b装置,放硫酸铜溶液以检验硫化氢是否除净,最后通入放有溴水的b瓶中观察现象。
考点:考查乙炔与溴的反应,对实验装置、试剂的判断

管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4,它们燃烧的反应如下:2CO+O2 2CO2,2H2+O2
2CO2,2H2+O2 2H2O,CH4+2O2
2H2O,CH4+2O2 CO2+2H2O,根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是________;因此燃烧管道煤气的灶具如需改用烧天然气,灶具改进的方法是________进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是_____________。
CO2+2H2O,根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是________;因此燃烧管道煤气的灶具如需改用烧天然气,灶具改进的方法是________进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是_____________。
管道煤气中含有的烃类除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质如下表:
| | 乙烷 | 丙烷 | 丁烷 |
| 沸点(℃) | -88.6 | -42.1 | 0.5 |
试根据以上某个关键数据解释冬天有时管道煤气火焰很小,并且呈断续状态的原因是_____________。
)实验室制备硝基苯的方法是将苯与浓硫酸和浓硝酸的混合液加热到55~60 ℃反应,已知苯与硝基苯的基本物理性质如下表所示:
| | 熔点 | 沸点 | 状态 |
| 苯 | 5.51 ℃ | 80.1 ℃ | 液体 |
| 硝基苯 | 5.7 ℃ | 210.9 ℃ | 液体 |
(1)要配制浓硫酸和浓硝酸的混合酸的注意事项是_________。
(2)分离硝基苯和水的混合物的方法是________;分离硝基苯和苯的方法是__________________________。
(3)某同学用如图装置制取硝基苯:

①用水浴加热的优点是_____________________;
②指出该装置的两处缺陷___________________;___________。
下列说法正确的是
| A.丁烷的沸点高于丙醇 |
B. 与苯酚是同系物 与苯酚是同系物 |
| C.淀粉、纤维素互为同分异构体 |
| D.葡萄糖、果糖均能发生银镜反应 |

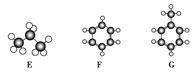
 可简写为
可简写为 。现有某化合物x的分子结构可表示为
。现有某化合物x的分子结构可表示为