题目内容
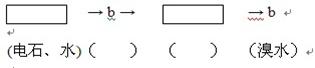
(6分)溴水在科学实验中具有重要的作用,如可用于物质的鉴别和分离提纯。将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,请列式计算原混合气体中乙烯和甲烷的物质的量之比是多少?
1∶5。
解析试题分析:混合气的总物质的量为n(混合)= 6.72L/22.4L·mol—1=0.3mol。在混合气体中乙烯能够与溴水发生加成反应,溴水增加的质量就是乙烯的质量。n(C2H4)= 1.4g/28g·mol—1=0.05mol。则n(CH4)=0.3mol-0.05 mol="0.25" mol;所以n(C2H4) ∶ n(CH4)= 0.05∶0.25 =1∶5 。
答:原混合气体中乙烯和甲烷的物质的量之比为1∶5。
考点:考查混合气体中各组成成分的物质的量的比的计算的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
体育比赛中当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部位喷射药剂——氯乙烷(沸点为12.27℃),进行局部冷冻麻醉应急处理。
(1)制取氯乙烷(CH3CH2Cl)的最好的方法是__________.
| A.乙烷与氯气发生取代反应 |
| B.乙烯与氯气发生加成反应 |
| C.乙烷与氯化氢反应 |
| D.乙烯与氯化氢发生加成反应 |
(3)决定氯乙烷能用于冷冻麻醉应急处理的理由是_______________________________________________。
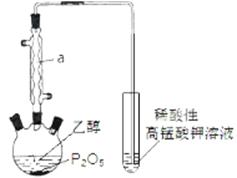
已知某种气态化石燃料含有碳和氢两种元素。为了
测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。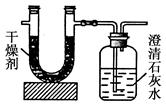
| | 实验前 | 实验后 |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为________g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)气态化石燃料中碳元素与氢元素的质量比为________。
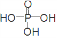
下列关于 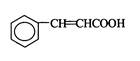 有机物的说法中错误的是
有机物的说法中错误的是
| A.分子式为C9H9O2 | B.能使Br2的CCl4溶液褪色 |
| C.能发生酯化反应 | D.能发生加聚反应 |
 )
) 