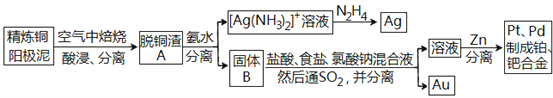
题目内容
【题目】甲醇燃料电池工作原理如下图,下列有关叙述正确的是( )
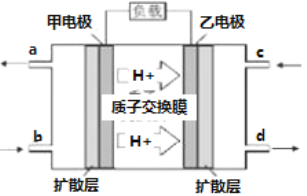
A. a导出的是H2O
B. 电池工作时,电子由甲电极经外电路流向乙电极
C. 乙电极的反应式为CH3OH+H2O-6e-=CO2+6H+
D. 将电解质改为NaOH溶液也能产生电流,但电流方向相反
【答案】B
【解析】A.根据原电池的工作原理。由质子定向移动可知甲为燃料电池的负极,负极电极反应式为CH3OH+H2O-6e-![]() CO2+6H+,,所以a导出的是CO2,故A错误;B. 电池工作时,电子经外电路由负极流向正极,即从甲电极经外电路流向乙电极,故B正确;C:乙为燃料电池的正极,电子在故正极反应式为O2+4e-+4H+
CO2+6H+,,所以a导出的是CO2,故A错误;B. 电池工作时,电子经外电路由负极流向正极,即从甲电极经外电路流向乙电极,故B正确;C:乙为燃料电池的正极,电子在故正极反应式为O2+4e-+4H+![]() 2 H2O,故C错误;D. 将电解质改为NaOH溶液也能产生电流,负极发生的反应为:CH3OH+8OH- -6e-
2 H2O,故C错误;D. 将电解质改为NaOH溶液也能产生电流,负极发生的反应为:CH3OH+8OH- -6e-![]() CO32-+6H2O,,正极反应式为O2+4e-+2H2O -
CO32-+6H2O,,正极反应式为O2+4e-+2H2O -![]() 4OH-电流方向不变,故D错误;答案:B。
4OH-电流方向不变,故D错误;答案:B。

【题目】铋是一种绿色稀有金属,铋及其化合物在工业生产中用途广泛,工业上常采用粗铋精炼制得用途更为广泛的精炼铋(含铋99.995%),火法精炼铋的工艺流程如下:

已知:①粗铋(铅铋合金)的主要化学成分如下表:
元素 | Ag | Bi | Pb | As | Sb |
含量/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
②氯化铅熔点为498℃,密度为5.9g/cm3;铋的熔点为271℃,沸点为1470℃;BiCl3的熔点为506.5℃。
③锌酸盐简写成ZnO22-,如锌酸钠Na2ZnO2。
④+3价铋的化合物较为稳定,铋酸钠难溶于水。
回答下列问题:
(1)实验室中升温熔化粗铋一般用酒精喷灯在________(填主要仪器名称)中完成。
(2)NaBiO3中铋元素的化合价为________。
(3)“氧化除砷锑”的工艺机理是粗铋熔融液在680~750℃的条件下,鼓入压缩空气,使砷、锑氧化挥发,同时空气也与铋液反应,利用Bi2O3的_______性将杂质砷、锑转变成As2O3、Sb2O3而除去。
(4)“氯化除铅”过程中,氯气与铅、铋反应分别生成PbCl2、BiCl3,生成的BiCl3又会被铅还原,发生反应3Pb+2BiCl3=3PbC12+2Bi,控制温度350-400℃,利用熔点和密度特点,氯化铅上浮至铋液表面呈_______态覆盖,防止氯气__________________。
(5)高温精炼的实质为碱性精炼,加入少量KNO3和NaOH,将锌氧化成锌酸盐而除去残锌,同时得到氮气,写出高温精炼的化学方程式: __________________。
(6)向含有MnSO4的酸性溶液中加入铋酸钠粉末,溶液变为紫红色,该反应经常用来检验Mn2+,写出该反应的离子方程式__________________。