题目内容
图中A~H均为中学化学中常见的物质,A是黄绿色气体,B和H都是无色气体,它们之间有如下转化关系.(反应中生成的水已略去)

请回答以下问题:
(1)E是 ,F是 ,H是 .(填化学式)
(2)C物质在日常生活中可作 剂.
(3)写出反应①的化学方程式: .

请回答以下问题:
(1)E是
(2)C物质在日常生活中可作
(3)写出反应①的化学方程式:
分析:A是黄绿色气体,应为Cl2,与石灰乳反应生成CaCl2和Ca(ClO)2,G在光照下反应,应为HClO,生成气体H为O2,则F为HCl,所以C应为Ca(ClO)2,D为CaCl2,无色气体B应为CO2,沉淀E为CaCO3,以上推断符合题目转化关系,结合物质的性质和题目要求解答该题.
解答:解:A是黄绿色气体,应为Cl2,与石灰乳反应生成CaCl2和Ca(ClO)2,G在光照下反应,应为HClO,生成气体H为O2,则F为HCl,所以C应为Ca(ClO)2,D为CaCl2,无色气体B应为CO2,沉淀E为CaCO3,
(1)由以上分析可知E为CaCO3,F为HCl,H为O2,故答案为:CaCO3;HCl;O2;
(2)C为Ca(ClO)2,与酸反应生成HClO,具有强氧化性,可用于消毒或漂白,故答案为:消毒(或漂白);
(3)反应①为Cl2与石灰乳反应生成CaCl2和Ca(ClO)2,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(1)由以上分析可知E为CaCO3,F为HCl,H为O2,故答案为:CaCO3;HCl;O2;
(2)C为Ca(ClO)2,与酸反应生成HClO,具有强氧化性,可用于消毒或漂白,故答案为:消毒(或漂白);
(3)反应①为Cl2与石灰乳反应生成CaCl2和Ca(ClO)2,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评:本题考查无机物的推断,题目难度不大,本题注意把握常见物质的颜色以及常见反应,为解答该题的关键,注意把握相关物质的性质,学习中注意积累.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
| |||||||||||||||||||
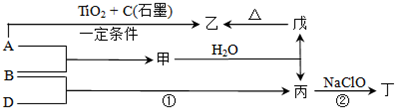
 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).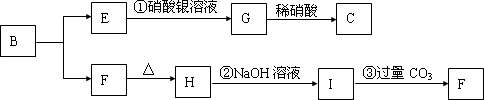
 (08黄冈中学二模)(15分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。
(08黄冈中学二模)(15分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。