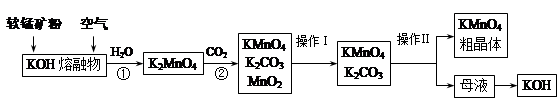题目内容
软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO2和Na2SO4。其工艺流程如下:
(1)I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。写出MnO2、CuS与硫酸反应的化学方程式: ;
(2)已知Fe(OH)3、Al(OH)3、Zn(OH)2三种物质开始沉淀和完全沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.6 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |
则III中调节溶液的pH至5.2~5.4,此时生成沉淀M的成分为 (写化学式),III中加入MnO2的作用是 ;
(3)Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水)如图,则IV中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、 、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是 ;

(4)V是用惰性电极电解制得Zn和MnO2,则阳极的电极反应式为 ;
(5)绿色化学思想在本工艺中得到了充分体现,在本工艺流程中可循环使用的主要物质有:MnO2、ZnCO3、MnCO3、 和 (写化学式)。
(16分)
(1)MnO2 + CuS+ 2H2SO4 ="S" + MnSO4 + CuSO4+2H2O(3分)
(2)Fe(OH)3、Al(OH)3(各1分) 将Fe2+氧化成Fe3+(2分)
(3)趁热过滤(2分) 防止形成 Na2SO4·10H2O(2分)
(4)Mn2+—2e-+2H2O = MnO2+4H+(3分)
(5)Zn、H2SO4(各1分)
解析试题分析:(1)依题意,MnO2、CuS、H2SO4反应生成MnSO4、CuSO4、S、H2O,锰元素由+4降为为+2价,硫元素由—2升为0价,根据最小公倍数法配平,则该反应为MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O;(2)根据表中信息,若溶液pH调至5.2~5.4,则溶液中的铁离子、铝离子都被完全除去,分别变为氢氧化铁沉淀、氢氧化铝沉淀,所以沉淀M的成分为Fe(OH)3、Al(OH)3;II中加入适量Zn,充分反应后过滤,得到Cu,由此推断发生的反应为Zn+Cu2+=Zn2++Cu、Cu+2Fe3+=Cu2++2Fe2+,则II的滤液中无铁离子,只有亚铁离子,为了将亚铁离子除去,需要先将其氧化为铁离子,再调节溶液pH将其完全变为氢氧化铁沉淀,因此III中加入的二氧化锰是将Fe2+氧化成Fe3+的氧化剂,即MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(3)读图,硫酸钠的溶解度随温度降低逐渐增大,而十水硫酸钠的溶解度随温度降低明显减小,由此说明从IV溶液中制取硫酸钠固体的方法是蒸发浓缩、趁热过滤、洗涤、干燥,而制取十水硫酸钠固体的方法是蒸发浓缩、冷却结晶、洗涤、干燥;用乙醇洗涤硫酸钠固体时,不会析出十水硫酸钠,用水洗涤硫酸钠固体时,随着温度的降低,硫酸钠溶解度增大,容易洁净析出十水硫酸钠固体;(4)电解前,V溶液中含有锌离子、锰离子,由此推断电解时锌元素由+2降为0价,得到电子,发生还原反应,说明Zn是阴极产物;锰元素由+2升为+4价,失去电子,发生氧化反应,说明二氧化锰是阳极产物,即Mn2+—2e-→MnO2;左边带4个正电,右边不带电,呈酸性的V溶液中只能用氢离子使左右电荷守恒,则Mn2+—2e-→MnO2+4H+;左边比右边少4H、2O,根据原子个数守恒可得阳极反应式:Mn2+—2e-+2H2O=MnO2+4H+;(5)根据流程图中主要步骤的反应物和生成物推断,V的生成物有二氧化锰、锌、硫酸,它们分别是III、II、I的反应物,IV产生的碳酸锌是III的反应物,它们都可以循环利用。
考点:考查物质制备的化学工艺流程,涉及氧化还原反应方程式的配平、滤渣的成分、解释加入试剂的目的、根据溶解度曲线推断制取晶体的操作方法、解释采取某措施的原因、阳极反应式、可以循环利用的物质等。

下图是一套实验制取气体的装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是
| A.铜屑和稀硝酸 | B.碳酸钙和稀盐酸 |
| C.二氧化锰和浓盐酸 | D.氧人钙和浓氨水 |

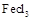 易升华。工业上制备无水的
易升华。工业上制备无水的
 Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。