题目内容
Ⅰ氨气在工农业有着广泛的用途.已知25%氨水的密度为0.91g/cm3,5%氨水的密度为0.98g/cm3.(1)配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数).
(2)若将上述两溶液等体积混合,所得氨水溶液的质量分数是______.
A.等于15% B.大于15% C.小于15% D.无法估算.
Ⅱ已知:4NH3+5O2
 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3(1)设空气中氧气的体积分数为0.20,氮气的体积分数为0.80.
①a mol NO完全转化为HNO3理论上需要氧气______mol.
②为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为______ (保留2位小数).
(2)20.0mol NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量硝酸,以及其他成分(高温下NO与O2不化合).计算氨转化为NO和HNO3的转化率.
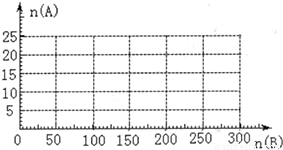
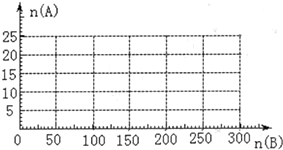
(3)20.0mol NH3和一定量空气充分反应后,再转化为硝酸.通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线.
【答案】分析:I(1)先根据C= 计算浓氨水的物质的量浓度,再根据溶液稀释前后溶质的物质的量不变计算浓氨水的体积;
计算浓氨水的物质的量浓度,再根据溶液稀释前后溶质的物质的量不变计算浓氨水的体积;
(2)氨水浓度越大密度越小,等体积相混合时,浓度较稀的氨水质量较大,而较浓的氨水的质量较小,这样混合后,所得溶液浓度当然要比15%偏小些;
II(1)①根据一氧化氮和氧气之间的关系式计算;
②根据氨气计算需要氧气的量,再根据体积分数公式进行计算;
(2)根据反应过程中氮气的量不变进行计算,算出生成硝酸的物质的量,再根据原子守恒计算转化率;
(3)采用极限法找出氨气、空气和硝酸的关系,并画出硝酸和空气的关系图象.
解答:解:(1)浓氨水的物质的量浓度= mol/L=13.4mol/L,设浓氨水的体积为v,2.5mol/L×0.1L=13.4mol/L×V,V=0.01868L=18.68mL,
mol/L=13.4mol/L,设浓氨水的体积为v,2.5mol/L×0.1L=13.4mol/L×V,V=0.01868L=18.68mL,
故答案为:18.68mL;
(2)若两种氨水等质量混合,则混合后氨水的质量分数为15%,等体积的两种氨水,浓的密度较小,所以质量较小,两种氨水混合后,质量分数更接近稀氨水的浓度,所得氨水溶液的质量分数小于15%,故选C;
(2)①根据4NO+3O2+2H2O→4HNO3知,a mol NO完全转化为HNO3理论上需要氧气=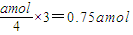 ,故答案为:0.75a;
,故答案为:0.75a;
②假设氨气的体积是4L,设需要空气的体积为y,
4NH3+5O2 4NO+6H2O
4NO+6H2O
4 5
4L 0.20y
y= L=25L,
L=25L,
氨-空气混合物中氨的体积分数=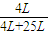 =0.14,
=0.14,
故答案为:0.14;
(2)设生成x mol HNO3,空气中氮气的量是氧气的4倍,4(2x+18.0× +12.0)=150.0 x=1.5(mol)
+12.0)=150.0 x=1.5(mol)
根据氮原子守恒,NH3的转化为HNO3的转化率=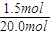 ×100%=7.5%
×100%=7.5%
NH3的转化为NO的转化率= ×100%=97.5%,
×100%=97.5%,
答:氨转化为NO和HNO3的转化率分别是7.5%和97.5%.
(3)4NH3+5O2 4NO+6H2O①,4NO+3O2 +2H2O→4HNO3②,将
4NO+6H2O①,4NO+3O2 +2H2O→4HNO3②,将 得NH3+2O2→H2O+HNO3③,由①③知,当n(O2):n(NH3)≤5:4,即n(空气):n(NH3)≤25:4时无硝酸生成,此时20.0mol氨气所需空气量为:
得NH3+2O2→H2O+HNO3③,由①③知,当n(O2):n(NH3)≤5:4,即n(空气):n(NH3)≤25:4时无硝酸生成,此时20.0mol氨气所需空气量为: ;
;
当5:4≤n(O2):n(NH3)≤2:1,即25:4≤n(空气):n(NH3)≤10:1时有硝酸生成,此时20.0mol氨气所需空气量为10×20.0mol=200mol,生成硝酸的物质的量是20mol,所以HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线为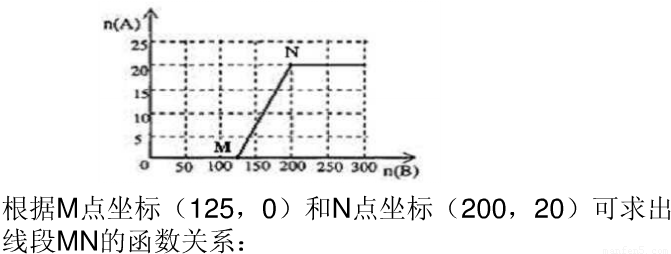 ,
,
故答案为: .
.
点评:本题考查氨气的性质和有关反应,难点是画出硝酸和空气物质的量之间的关系图象,采用极限法来分析解答,难度较大.
 计算浓氨水的物质的量浓度,再根据溶液稀释前后溶质的物质的量不变计算浓氨水的体积;
计算浓氨水的物质的量浓度,再根据溶液稀释前后溶质的物质的量不变计算浓氨水的体积;(2)氨水浓度越大密度越小,等体积相混合时,浓度较稀的氨水质量较大,而较浓的氨水的质量较小,这样混合后,所得溶液浓度当然要比15%偏小些;
II(1)①根据一氧化氮和氧气之间的关系式计算;
②根据氨气计算需要氧气的量,再根据体积分数公式进行计算;
(2)根据反应过程中氮气的量不变进行计算,算出生成硝酸的物质的量,再根据原子守恒计算转化率;
(3)采用极限法找出氨气、空气和硝酸的关系,并画出硝酸和空气的关系图象.
解答:解:(1)浓氨水的物质的量浓度=
 mol/L=13.4mol/L,设浓氨水的体积为v,2.5mol/L×0.1L=13.4mol/L×V,V=0.01868L=18.68mL,
mol/L=13.4mol/L,设浓氨水的体积为v,2.5mol/L×0.1L=13.4mol/L×V,V=0.01868L=18.68mL,故答案为:18.68mL;
(2)若两种氨水等质量混合,则混合后氨水的质量分数为15%,等体积的两种氨水,浓的密度较小,所以质量较小,两种氨水混合后,质量分数更接近稀氨水的浓度,所得氨水溶液的质量分数小于15%,故选C;
(2)①根据4NO+3O2+2H2O→4HNO3知,a mol NO完全转化为HNO3理论上需要氧气=
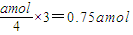 ,故答案为:0.75a;
,故答案为:0.75a; ②假设氨气的体积是4L,设需要空气的体积为y,
4NH3+5O2
 4NO+6H2O
4NO+6H2O4 5
4L 0.20y
y=
 L=25L,
L=25L,氨-空气混合物中氨的体积分数=
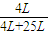 =0.14,
=0.14,故答案为:0.14;
(2)设生成x mol HNO3,空气中氮气的量是氧气的4倍,4(2x+18.0×
 +12.0)=150.0 x=1.5(mol)
+12.0)=150.0 x=1.5(mol)根据氮原子守恒,NH3的转化为HNO3的转化率=
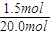 ×100%=7.5%
×100%=7.5% NH3的转化为NO的转化率=
 ×100%=97.5%,
×100%=97.5%,答:氨转化为NO和HNO3的转化率分别是7.5%和97.5%.
(3)4NH3+5O2
 4NO+6H2O①,4NO+3O2 +2H2O→4HNO3②,将
4NO+6H2O①,4NO+3O2 +2H2O→4HNO3②,将 得NH3+2O2→H2O+HNO3③,由①③知,当n(O2):n(NH3)≤5:4,即n(空气):n(NH3)≤25:4时无硝酸生成,此时20.0mol氨气所需空气量为:
得NH3+2O2→H2O+HNO3③,由①③知,当n(O2):n(NH3)≤5:4,即n(空气):n(NH3)≤25:4时无硝酸生成,此时20.0mol氨气所需空气量为: ;
;当5:4≤n(O2):n(NH3)≤2:1,即25:4≤n(空气):n(NH3)≤10:1时有硝酸生成,此时20.0mol氨气所需空气量为10×20.0mol=200mol,生成硝酸的物质的量是20mol,所以HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线为
 ,
,故答案为:
 .
.点评:本题考查氨气的性质和有关反应,难点是画出硝酸和空气物质的量之间的关系图象,采用极限法来分析解答,难度较大.

练习册系列答案
相关题目
 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3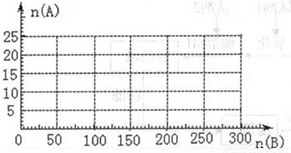
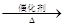 4NO+6NO,4NO+3O2+2H2O
4NO+6NO,4NO+3O2+2H2O 4HNO3
4HNO3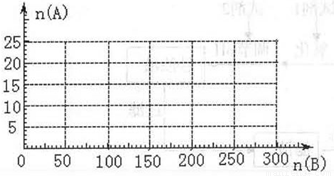
 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3