题目内容
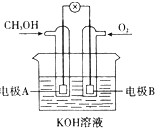 如图是一燃料电池的化学原理示意图,该燃料电池总反应化学方程式为:2CH3OH+3O2+4KOH
如图是一燃料电池的化学原理示意图,该燃料电池总反应化学方程式为:2CH3OH+3O2+4KOH| 放电 |
| 充电 |
| A、电极A为电池负极 |
| B、电极B表面上发生还原反应 |
| C、工作一段时间溶液pH保持不变 |
| D、燃料电池工作时不会出现火焰 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:燃料电池中,通入燃料甲醇的电极为负极,电极反应为CH3OH-6e-+2OH-=CO32-+3H2O,通入氧气的电极为正极,电极反应为2O2+4e-+2H2O=4OH-,负极上发生氧化反应、正极上发生还原反应,据此分析解答.
解答:
解:A.通入燃料的电极A为负极,故A正确;
B.电解B表面上氧气得电子发生还原反应,故B正确;
C.根据电池反应式知,KOH参加反应且生成水,导致溶液中KOH浓度降低,则溶液的pH减小,故C错误;
D.燃料电池是将化学能转化为电能,不是燃料燃烧,所以没有火焰产生,故D正确;
故选C.
B.电解B表面上氧气得电子发生还原反应,故B正确;
C.根据电池反应式知,KOH参加反应且生成水,导致溶液中KOH浓度降低,则溶液的pH减小,故C错误;
D.燃料电池是将化学能转化为电能,不是燃料燃烧,所以没有火焰产生,故D正确;
故选C.
点评:本题考查了原电池原理,根据得失电子确定正负极,再结合电池反应分析解答,题目难度不大.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
某化学课外活动小组,进行关于溶液中离子检验的探索性实验.下列是A、B、C、D四位同学分别对四个不同试样的检验结果.其中合理的是( )
| A、K+、H+、SO42-、OH- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、Cu2+、Na+、Cl-、SO42- |
下列说法不正确的是( )
| A、加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-;加入酚酞呈红色的溶液:SO42-、K+、Cl-、HSO3- 分别都不能大量共存(常温下) | ||
B、
| ||
| C、已知:25℃时,Mg(OH)2的kSP=5.61×10-12,MgF2的kSP=7.42×10-11,25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2 可以转化为MgF2 | ||
D、表示H2燃烧热的化学方程式为:H2(g)+
|
230Th和232Th是90号元素钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
| A、230Th的中子数比核外电子数多140 |
| B、230Th和232Th的化学性质相同 |
| C、232Th转换成233U是化学变化 |
| D、Th元素的相对原子质量是231 |
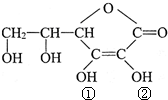 维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,结构如图,下列关于维生素C正确的是( )
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,结构如图,下列关于维生素C正确的是( )| A、维生素C能使酸性高锰酸钾溶液褪色 |
| B、维生素C由于含有酯基而难溶于水 |
| C、维生素C酸性可能是①②两个羟基引起的 |
| D、维生素C由于含有C=O键而能发生银镜反应 |
现有物质的量浓度为0.1mol/L的盐酸和0.1mol/L的氨水,下列说法中正确的是( )
| A、用湿润的pH试纸测定两种溶液的pH时,氨水的误差更大 |
| B、若混合后溶液恰好呈中性时:c(Cl-)=c(NH4+)+c(NH3?H2O) |
| C、两溶液等体积混合时,充分反应后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、恰好反应呈中性时,所需氨水的体积大于盐酸的体积 |
下列说法正确的是( )
| A、常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性 |
| B、已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强 |
| C、将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3?H2O) |
| D、已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 |
下列离子方程式,正确的是( )
| A、在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O |
| B、碳酸钠溶液中加入二氧化硅:CO32-+SiO2═SiO32-+CO2↑ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸与烧碱溶液中和:H2SiO3+2OH-═SiO32-+2H2O |
