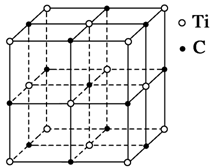
题目内容
已知A元素原子核外电子共占有5个轨道且有2个成单电子;B元素原子核外能量最高电子为:n=3、l=1、m=1、ms=+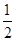 ,n=3、l=1、m=0、ms=+
,n=3、l=1、m=0、ms=+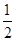 。则A、B两元素所形成化合物的晶体类型为( )。
。则A、B两元素所形成化合物的晶体类型为( )。
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
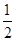 ,n=3、l=1、m=0、ms=+
,n=3、l=1、m=0、ms=+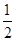 。则A、B两元素所形成化合物的晶体类型为( )。
。则A、B两元素所形成化合物的晶体类型为( )。A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
B
A的核外电子排布式为1s22s22p4,A为O元素;B有3个电子层,且最高能量的电子有2个且为p电子,那么B为1s22s22p63s23p2,B为Si。SiO2为原子晶体。

练习册系列答案
相关题目