题目内容
(12分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。合成氨反应:N2(g)+3H2(g) 2NH3(g)△H
2NH3(g)△H
(1)若该反应在一定条件下能自发,则该反应的△H 0、△S 0(填“<”、“>”或“=”)。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是 。
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表的①②处填入合适的实验条件数据。
 2NH3(g)△H
2NH3(g)△H(1)若该反应在一定条件下能自发,则该反应的△H 0、△S 0(填“<”、“>”或“=”)。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是 。
| A.3v(H2)正=2v(NH3)逆 |
| B.单位时间内生成n mol N2的同时生成2n molNH3 |
| C.混合气体的密度不再改变 |
| D.容器内压强不随时间的变化而变化 |
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表的①②处填入合适的实验条件数据。
| 实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) | 平衡时NH3百分含量 |
| ⅰ | 450 | 1/3 | 1 | |
| ⅱ | ① | 1/3 | ② | |
| ⅲ | 480 | 1/3 | 10 | |
(1) < ,< (每空1分) (2) BD (2分)
(3) 0.2mol/(L· min) 、 0.058 、 减小 (每空2分)
(4)① 450(或480) 、② 10(或1) 。(每空1分)
(3) 0.2mol/(L· min) 、 0.058 、 减小 (每空2分)
(4)① 450(或480) 、② 10(或1) 。(每空1分)
(1)根据方程式可知△S<,又因为反应是自发的,所以△H<0。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率的方向相反,但满足速率之比是相应的化学计量数之比,不正确。B中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。反应前后体积减小,所以压强也是减小的,D可以说明。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,C不正确。答案选BD。
(3)容器中有0.4mol NH3,则消耗氮气是0.2mol,所以其反应速率是0.2mol÷2L÷0.5min=0.2mol/(L·min)。平衡时氢气、氮气、氨气的浓度分别是1.2mol/L、0.4mol/L、0.2mol/L,所以平衡常数K=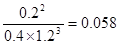 。正反应是放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小。
。正反应是放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小。
(1)如果实验①②中温度相同,则压强就不同,反之亦然,同样实验②③中压强相同,温度就不同,反之亦然。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率的方向相反,但满足速率之比是相应的化学计量数之比,不正确。B中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。反应前后体积减小,所以压强也是减小的,D可以说明。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,C不正确。答案选BD。
(3)容器中有0.4mol NH3,则消耗氮气是0.2mol,所以其反应速率是0.2mol÷2L÷0.5min=0.2mol/(L·min)。平衡时氢气、氮气、氨气的浓度分别是1.2mol/L、0.4mol/L、0.2mol/L,所以平衡常数K=
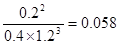 。正反应是放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小。
。正反应是放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小。(1)如果实验①②中温度相同,则压强就不同,反之亦然,同样实验②③中压强相同,温度就不同,反之亦然。

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
 2Z(g)
2Z(g) CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。 2SO3。请填写下列空白:
2SO3。请填写下列空白:
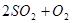
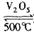
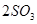 。如果反应在密闭容器中进行,下列说法错误的是
。如果反应在密闭容器中进行,下列说法错误的是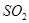 的物质的量不再改变时,该反应达到了平衡状态
的物质的量不再改变时,该反应达到了平衡状态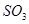 的浓度一定相等
的浓度一定相等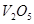 催化剂是为了加快反应速率,提高生产效率
催化剂是为了加快反应速率,提高生产效率 Z(g) ⊿H>0。经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g) ⊿H>0。经60s达到平衡,生成0.3mol Z。下列说法正确的是 H2(g)+CO(g)。
H2(g)+CO(g)。 2C(g) △H<0
2C(g) △H<0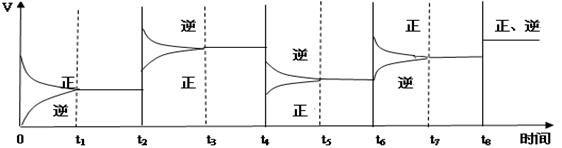
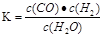
 2C在不同温度下的平衡常数:
2C在不同温度下的平衡常数: A+B的平衡常数为0.05,可推知t的范围是( )
A+B的平衡常数为0.05,可推知t的范围是( )