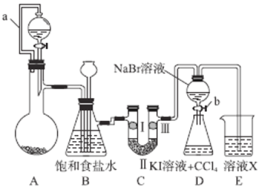
题目内容
【题目】以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成分为Fe(CrO2)2]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:
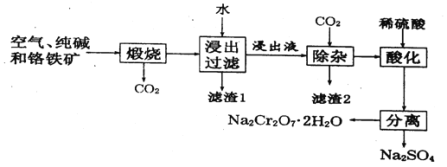
己知:铬铁矿在空气中与纯减煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,
且 Al2O3+Na2CO3![]() 2NaAlO2+ CO2↑。请回答:
2NaAlO2+ CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为___________。
(2)滤渣2的成分为_____________。
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是_________。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol/L以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:
加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于________________mol/L,后续废水处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。写出酸性条件下CrO42-与绿巩在溶液中反应的离子方程式:_________________________________。
Cr(OH)3。写出酸性条件下CrO42-与绿巩在溶液中反应的离子方程式:_________________________________。
(5)某高效净水剂是由K2FeO4得到的,工业上以溶液w、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的离子方程式是______________________。
【答案】(1)+3(1分)(2)Al(OH)3(2分)
(3)取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红,证明有Fe3+(其他合理答案也可)(2分)
(4)①2.4×10-4(2分)②CrO+3Fe2++8H+==Cr3++3Fe3++4H2O(2分)
(5)Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O(2分)
【解析】
试题分析:(1)在铬铁矿Fe(CrO2)2中,Fe的化合价为+2,所以Cr的化合价为+3;
(2)含杂质的铬铁矿经煅烧、溶于水后,只有氧化铁不溶于水,作为滤渣除去,所以滤渣1的成分是Fe2O3,此时溶液为Na2CrO4和 NaAlO2的混合液,通入CO2气体会和NaAlO2反应产生Al(OH)3,所以滤渣2的成分是Al(OH)3;
(3)将滤渣l放入稀硫酸溶解后得溶液W为Fe2(SO4)3,检验Fe3+的方法是取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红,证明有Fe3+;
(4)①Ksp(BaCrO4)=1.2×10-10,c(CrO42-)<5.0×10-7 mo1/L,所以c(Ba2+)>1.2×10-10/5.0×10-7=2.4×10-4 mo1/L;
②酸性条件下 CrO42-与绿矾FeSO4 7 H2O反应,CrO42-作氧化剂,绿矾作还原剂,其离子方程式为CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O;
(5)W 为Fe2(SO4)3,以溶液Fe2(SO4)3、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的离子方程式是Fe3++3ClO- +10OH-=2FeO42-+3Cl-+5H2O。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】Ⅰ.现有下列十种物质:①O2;②Fe;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体;⑧硫酸钠溶液;⑨稀硝酸;⑩Cu2(OH)2CO3。
(1)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | _____ | ⑧⑨ | _____ |
(2)上述物质中属于非电解质的有_________;上述物质中能与盐酸反应的电解质有________。
Ⅱ.(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是_________,还原产物是_________,氧化产物与还原产物的质量比是_________。
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2,转移电子的数目为___________。
Ⅲ.Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程,据此回答下列问题:
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ _________+ ________![]() _________+ ________+H2O
_________+ ________+H2O