题目内容
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于____区。
(2)Fe-Cr-Al合金可作为汽车尾气催化剂的载体,汽车尾气催化剂可将NO2还原为无毒害的气体,防止HNO3型酸雨的形成,NO2的空间构型为____。HNO3的酸性强于HNO2的原因为___。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为___(用含π的式子表示)。
【答案】d V型 HNO3中N的化合价为+5价,其N的正电性强于HNO2中N,使羟基中O-H键的共用电子对更易偏向O原子,羟基更易电离出H+,故酸性HNO3强于HNO2 ![]()
【解析】
铁元素位于元素周期表Ⅷ族;酸越易电离出氢离子,酸的酸性越强;空间利用率=![]() 。
。
(1)铁元素位于元素周期表Ⅷ族,按照电子排布铁元素属于d区。
(2)NO2的孤电子对=![]() ,计算出来的孤电子对不是整数,这时应当作1来对待,因为单电子也要占据一个孤对电子轨道,综上所述 NO2的价层电子对=2+1,所以NO2的VSEPR模型为平面三角形,NO2的空间构型为V型;HNO3中N的化合价为+5价,其N的正电性强于HNO2中N,使羟基中O-H键的共用电子对更易偏向O原子,羟基更易电离出H+,故酸性HNO3强于HNO2。
,计算出来的孤电子对不是整数,这时应当作1来对待,因为单电子也要占据一个孤对电子轨道,综上所述 NO2的价层电子对=2+1,所以NO2的VSEPR模型为平面三角形,NO2的空间构型为V型;HNO3中N的化合价为+5价,其N的正电性强于HNO2中N,使羟基中O-H键的共用电子对更易偏向O原子,羟基更易电离出H+,故酸性HNO3强于HNO2。
(3)设铁原子的半径为rcm,则晶胞体积对角线长度为4r cm,可知晶胞棱长为![]() cm,晶胞中Fe原子数目为
cm,晶胞中Fe原子数目为![]() ,晶胞中Fe原子总体积为
,晶胞中Fe原子总体积为![]() cm3,晶胞体积为
cm3,晶胞体积为![]() cm3,则空间利用率=
cm3,则空间利用率=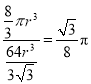 。
。

练习册系列答案
相关题目