题目内容
【题目】电解原理在化学工业中有广泛应用.图1表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 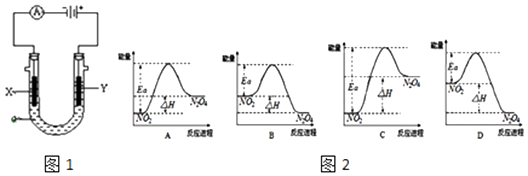
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则: ①X是极(填“阴”或“阳”),X极逸出(填“黄绿色”或“无色”)气体,同时X极附近溶液呈色.
②电解池中Y极上的电极反应式为 . X极上的电极反应式为 .
(2)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼(得到纯铜),电解液a选用CuSO4溶液,则: ①Y电极的材料是(填“粗铜”或“纯铜”).
②X电极的电极反应式是 .
③下列说法正确的是 .
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4 , 若将该反应设计为电解池,其电解质溶液需用 , 阳极材料是用 , 阴极电极反应式为
【答案】
(1)阴;无色;红;2Cl﹣﹣2e﹣=Cl2↑;2H++2e﹣=H2↑
(2)粗铜;Cu2++2e﹣=Cu;bd
(3)硫酸溶液;铜;O2+4H++4e﹣=2H2O
【解析】解:(1)①若X、Y都是惰性电极,a是饱和NaCl溶液,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e﹣=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红, 所以答案是:阴;无色;红;②Y电极与电源正极相连为阳极,氯离子放电生成氯气,电极反应式为2Cl﹣﹣2e﹣=Cl2↑,X电极与电源负极相连为阴极,氢离子放电,电极反应式为2H++2e﹣=H2↑,
所以答案是:2Cl﹣﹣2e﹣=Cl2↑;2H++2e﹣=H2↑;(2)①电解精炼中,粗铜作阳极,纯铜作阴极,Y电极与电源正极相连为阳极,所以Y电极的材料是粗铜,所以答案是:粗铜;②X电极与电源负极相连为阴极,电极反应式是Cu2++2e﹣=Cu,所以答案是:Cu2++2e﹣=Cu;③a.电能不能全部转化为化学能,还有部分转化为热能,故错误;
b.在电解精炼过程中,阳极上为活泼金属放电,所以电解液中伴随有Al3+、Zn2+产生,故正确;
c.溶液中Cu2+向阴极移动,故错误;
d.在阳极的底部可回收不活泼金属,如Ag、Pt、Au,故正确;
故选bd;(3)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应,所以若将该反应设计为电解池,其电解质溶液需用稀硫酸,阳极材料是用铜,阴极电极反应式为O2+4H++4e﹣=2H2O,
所以答案是:硫酸溶液;铜;O2+4H++4e﹣=2H2O.

