题目内容
12.熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,甲醇为负极燃气,空气与CO2的混合气体为正极助燃气,制得在650℃下工作的燃料电池,正极反应式:O2+4e-+2CO2=2CO32-;负极反应式:CH3OH+3CO32--6e-═4CO2+2H2O.分析 该燃料电池中,负极上甲醇失电子和碳酸根离子反应生成二氧化碳,据此分析解答.
解答 解:该熔融盐燃料电池中,负极上燃料甲醇失电子和碳酸根离子反应生成二氧化碳,电极反应式为CH3OH+3CO32--6e-═4CO2+2H2O,
故答案为:CH3OH+3CO32--6e-═4CO2+2H2O.
点评 本题考查化学电源新型电池,侧重考查电极反应式的书写,燃料电池电极反应式的书写是学习难点,燃料电池中,负极上燃料失电子、正极上氧化剂得电子,题目难度中等.

练习册系列答案
相关题目
3.在下列各组物质中,分子数相同的是( )
| A. | 2LCO和2L CO2 | |
| B. | 9克H2O和标准状况下11.2L CO2 | |
| C. | 标准状况下1mol O2和22.4L H2O | |
| D. | 0.2mol H2和标准状况下4.48L HCl气体 |
7.下列方程式正确的是( )
| A. | 向漂白粉溶液中加浓HCl:Cl-+ClO-+H2O═Cl2↑+2OH- | |
| B. | 醋酸钠溶液显碱性:CH3COO-+H2O═CH3COOH+OH- | |
| C. | 向明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:2Ba2++2SO42-+Al3++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 电解MgCl2水溶液:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH- |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24 L HF含有的HF分子数为0.1NA | |
| B. | 在常温常压下,32 g 18O2中含有2NA氧原子 | |
| C. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA |
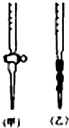 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.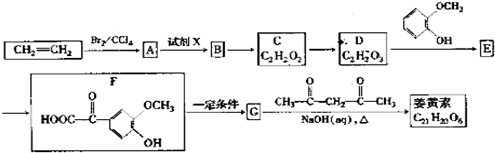

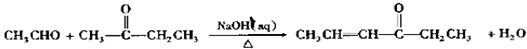

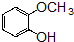 +OHCCOOH→
+OHCCOOH→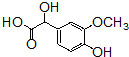 ,其反应类型是加成反应.
,其反应类型是加成反应.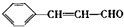 ),写出制备肉桂醛所需有机物的结构简式C6H5CHO、CH3CHO.
),写出制备肉桂醛所需有机物的结构简式C6H5CHO、CH3CHO.