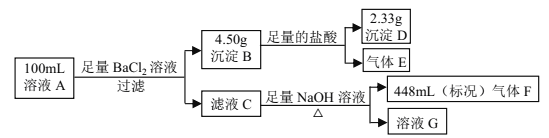
题目内容
【题目】在压强为0.1 MPa、10L恒容的密闭容器中, 将2 mol CO与 5 mol H2的混合气体在催化剂作用下能生成甲醇:CO(g) + 2H2(g)![]() CH3OH(g) △H<0 请回答下列问题:
CH3OH(g) △H<0 请回答下列问题:
(1)①该反应的熵变ΔS__________0(填“>”、“<”或“=”)。
②若温度T1 >T2,则平衡常数K(T1)___________K(T2)(填“大于”、“小于”或“等于”)
③下列措施既可加快反应速率又可增加甲醇产率的是__________;
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入2 mol CO和5 mol H2
④下列可说明反应已达到化学平衡状态的是________;
A.v生成(CH3OH)=v消耗(CO) B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.CO与H2浓度比不再变化
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为________mol;
②反应的平衡常数K=______________;
③反应在0-5min区间的平均反应速率v(H2)=____________。
【答案】<小于DCD4.00.75 L2/mol20.06 mol·L-1·min-1
【解析】(1)①该反应中,反应物的系数和大于产物气体系数和,所以该反应是熵减的反应,熵变小于零;
②该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故平衡常数K(T1)小于K(T2);
③A.升高温度,化学反应速率加快,平衡逆向进行,会减小甲醇产率,故A错误;B.将CH3OH(g)从体系中分离,化学反应速率减慢,平衡正向移动,提高甲醇的产率,故B错误;C.充入He,使体系总压强增大,体积不变,各组分浓度不变,所以化学反应速率不变,平衡不会移动,不会改变甲醇产率,故C错误;D.再充入2 molCO和5 molH2,增大压强,化学反应速率加快,平衡正向移动,有利提高甲醇的产率,故D正确;故答案为D;
④CO(g)+2H2(g)═CH3OH(g);A.v生成(CH3OH)是正反应速率,v消耗(CO)也是反应速率,故不能说明达到平衡状态,故A错误;B.密度=![]() ,总质量不变,体积不变,故混合气体的密度不变,故混合气体的密度不再改变不能说明达到平衡状态,故B错误;C.平均相对分子质量=
,总质量不变,体积不变,故混合气体的密度不变,故混合气体的密度不再改变不能说明达到平衡状态,故B错误;C.平均相对分子质量=![]() ,总质量不变,总物质的量会变,故混合气体的平均相对分子质量不再改变说明达到平衡状态,故C正确;D.CO与H2浓度比不再变化,说明达到平衡状态,故D正确;故答案为CD;
,总质量不变,总物质的量会变,故混合气体的平均相对分子质量不再改变说明达到平衡状态,故C正确;D.CO与H2浓度比不再变化,说明达到平衡状态,故D正确;故答案为CD;
(2)①若温度T2时,5 min后反应达到平衡,CO的转化率为75%,则反应的CO的物质的量为:2 mol×75%=1.5 mol,反应的氢气的物质的量为:1.5mol×2=3 mol,平衡时CO的物质的量为:2-1.5=0.5 mol,氢气的物质的量为5-3=2 mol,甲醇的物质的量为1.5 mol,故平衡时体系总的物质的量为0.5+2+1.5=4 mol;
②平衡时CO的物质的量为0.5 mol,氢气的物质的量为2 mol,甲醇的物质的量为1.5 mol,则平衡常数K=![]() =75 L2/mol2;
=75 L2/mol2;
③反应的氢气的物质的量为3mol,故v(H2)=![]() =0.06 molL-1min-1。
=0.06 molL-1min-1。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案