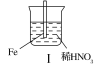
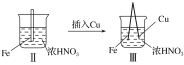
题目内容
【题目】已知甲烷(CH4)在一定条件下催化氧化可以生成乙烯(C2H4)、乙烷(C2H6)气体(水和其他产物忽略不计)。取一定量甲烷经催化氧化得到的混合气体在标准状况下的密度为0.85 g/L,实验测得反应中甲烷消耗了40.0%,求所得混合气体中乙烯的体积百分含量。
【答案】23%
【解析】
试题分析: 先由M=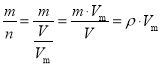 可知,混合气体的平均摩尔质量为0.85 g/L × 22.4L/mol = 19.04 g/mol;再设原有a mol CH4,后有(1-40.0%)×a mol CH4、b mol C2H4,c molC2H6,由分子组成关系式CH4~C、C2H4~2C、C2H6~2C可知,反应前后总的C原子的n为(1-40.0%)a mol + 2×b mol + 2×c mol = a mol;由平均摩尔质量=
可知,混合气体的平均摩尔质量为0.85 g/L × 22.4L/mol = 19.04 g/mol;再设原有a mol CH4,后有(1-40.0%)×a mol CH4、b mol C2H4,c molC2H6,由分子组成关系式CH4~C、C2H4~2C、C2H6~2C可知,反应前后总的C原子的n为(1-40.0%)a mol + 2×b mol + 2×c mol = a mol;由平均摩尔质量=![]() 可知,16×0.6a+28b+30c=19.04×(0.6a+b+c);解上述方程组可得:b+c=0.2a,b = 0.184 a,c = 0.0016a,混合气体中C2H4的体积百分含量为
可知,16×0.6a+28b+30c=19.04×(0.6a+b+c);解上述方程组可得:b+c=0.2a,b = 0.184 a,c = 0.0016a,混合气体中C2H4的体积百分含量为![]() ×100%=23%。
×100%=23%。

练习册系列答案
相关题目