题目内容
【题目】为探究苯与溴的取代反应,甲同学用装置I进行如下实验:
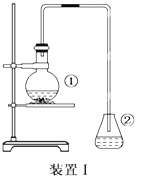
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3-5分钟后发现滴有AgNO3的锥形瓶中有浅黄色沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为____________________。
(2)①中长导管的作用是____________________。
(3)要得到纯净的产物,可用稀NaOH溶液、蒸馏水洗涤。洗涤分离粗产品后,检验产物已洗净的方法是_____________________。
(4)乙同学设计如图所示装置II,并用下列某些试剂完成该实验。可选用的试剂是:苯、液溴、浓硫酸、氢氧化钠溶液、硝酸银溶液、四氯化碳。
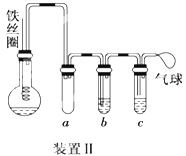
a的作用是________________。能证明苯和液溴发生的是取代反应,而不是加成反应,则试管b中应加入_______________,试管c中应加入________________。
(5)比较两套装置,装置Ⅱ的两个优点是:①__________________②____________________。
【答案】2Fe+3Br2═2FeBr3、![]() 导气、冷凝回流 取少量最后一次洗涤液,加入稀HNO3,再加入AgNO3溶液,溶液不浑浊说明产品已洗净 安全瓶,防止倒吸 四氯化碳 AgNO3溶液 可以防止倒吸 可以避免杂质干扰(或防止尾气污染空气)
导气、冷凝回流 取少量最后一次洗涤液,加入稀HNO3,再加入AgNO3溶液,溶液不浑浊说明产品已洗净 安全瓶,防止倒吸 四氯化碳 AgNO3溶液 可以防止倒吸 可以避免杂质干扰(或防止尾气污染空气)
【解析】
(1)溴与铁反应生成溴化铁,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢;
(2)长导管让挥发出来的溴单质冷凝,防止对产物的干扰;
(3)反应生成的溴苯中混有溴,可用NaOH溶液洗涤,因此产物中可能含有溴离子,只要检验是否存在溴离子即可;
(4)根据a中导管短进短出,结合生成物的性质分析解答;要证明苯和液溴发生的是取代反应,而不是加成反应,需要除去挥发出来的Br2,再检验有无溴化氢生成;
(5)根据装置Ⅱ中含有安全瓶、气球、装置b、铁丝可以上下移动等分析解答。
(1)因溴与铁反应生成溴化铁:2Fe+3Br2═2FeBr3,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢:![]() ,故答案为:2Fe+3Br2═2FeBr3;
,故答案为:2Fe+3Br2═2FeBr3;![]() ;
;
(2)反应为放热反应,长导管让挥发出来的溴和苯的蒸气冷凝,即长导管的作用为导气,冷凝回流,故答案为:导气、冷凝回流;
(3) 反应生成的溴苯中混有溴,可先后用NaOH溶液、蒸馏水进行洗涤,因此洗涤液中可能含有溴离子,溴离子可与硝酸银反应生成溴化银沉淀,因此检验产物已洗净的方法为:取少量最后一次洗涤液,加入稀HNO3,再加入AgNO3溶液,溶液不浑浊说明产品已洗净,故答案为:取少量最后一次洗涤液,加入稀HNO3,再加入AgNO3溶液,溶液不浑浊说明产品已洗净;
(4)从图上信息可知,导气管是短进短出的a的作用是防止倒吸,是一个安全装置,因为生成的溴化氢极易溶于水;要证明苯和液溴发生的是取代反应,而不是加成反应,需要除去挥发出来的Br2,可以选用四氯化碳洗气,再在试管c中检验溴离子,可以选用AgNO3溶液检验,故答案为:安全瓶,防止倒吸;四氯化碳;AgNO3溶液;
(5)根据以上分析,装置Ⅱ的主要优点有:①有安全瓶,可以防止倒吸;②存在洗气装置,可以避免杂质干扰;③装置II中有气球收集尾气,防止尾气污染空气,故答案为:可以防止倒吸;可以避免杂质干扰(或防止尾气污染空气)。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】某合金与铁的物理性质的比较如下表所示:(注:硬度以金刚石为10作标准,导电性以银的导电性100为标准)
熔点 | 密度 | 硬度 | 导电性 | |
某合金 | 32000C | 3.20g/cm3 | 7.5 | 3.5 |
铁 | 15350C | 7.86g/cm3 | 4.5 | 17 |
已知该合金耐腐蚀、强度大,从性能看,该合金不适合制
A.门窗框B.炉具C.电源线D.飞机外壳



