题目内容
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式_____。
(2)TiCl4熔点是﹣25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4﹣中B原子的杂化类型为_____。
(3)在 TiO2催化作用下,可将CN﹣氧化成CNO﹣,进而得到N2。与CNO﹣互为等电子体的分子化学式为(只写一种)________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色)。绿色晶体中配体是_______。
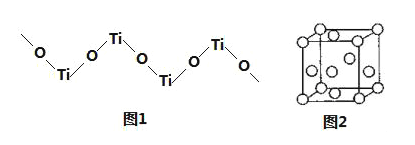
(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为______。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为ρgcm﹣3,阿伏加德罗常数为NA,则该晶胞的边长为___cm。
【答案】 3d24s2 分子 sp3 CO2(或N2O、CS2、BeCl2等) Cl﹣、H2O [TiO]n2n+ ![]()
【解析】(1)Ti的原子序数为22,Ti原子核外有22个电子,根据构造原理书写其外围电子排布式。
(2)TiCl4的熔沸点较低,可溶于苯或CCl4等非极性溶剂,TiCl4晶体属于分子晶体。BH4-中中心原子B上的孤电子对数=![]() (3+1-4
(3+1-4![]() 1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
(3)用“替换法”书写等电子体。
(4)绿色晶体的化学式为[TiCl(H2O)5]Cl2·H2O,绿色晶体的配体为Cl-和H2O。
(5)根据结构,其中Ti与O之比为1:1,Ti元素的化合价为+4价,O元素的化合价为-2价,钛酰离子的化学式为[TiO]n2n+。
(6)由晶体的密度和1mol晶体的质量计算1mol晶体的体积,用“均摊法”确定晶胞中粒子的个数,计算晶胞的体积,应用几何知识计算晶胞的边长。
(1)Ti的原子序数为22,Ti原子核外有22个电子,根据构造原理,基态Ti原子的核外电子排布式为1s22s22p63s23p63d24s2,Ti的基态原子的外围电子排布式为3d24s2。
(2)TiCl4的熔沸点较低,可溶于苯或CCl4等非极性溶剂,TiCl4晶体属于分子晶体。BH4-中中心原子B上的孤电子对数=![]() (3+1-4
(3+1-4![]() 1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
(3)用“替换法”,与CNO-互为等电子体的分子的化学式为CO2、N2O、CS2、BeCl2等。
(4)绿色晶体的化学式为[TiCl(H2O)5]Cl2·H2O,绿色晶体的配体为Cl-和H2O。
(5)根据结构,其中Ti与O之比为1:1,Ti元素的化合价为+4价,O元素的化合价为-2价,钛酰离子的化学式为[TiO]n2n+。
(6)1mol金属Ti的质量为48g,1mol金属Ti的体积为48g![]() ρg/cm3=
ρg/cm3=![]() cm3;用“均摊法”,1个晶胞中含Ti的个数为8
cm3;用“均摊法”,1个晶胞中含Ti的个数为8![]() +6
+6![]() =4;晶胞的体积为
=4;晶胞的体积为![]() cm3
cm3![]() NA
NA![]() 4=
4=![]() cm3;晶胞的边长为
cm3;晶胞的边长为![]() cm。
cm。

 阅读快车系列答案
阅读快车系列答案【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
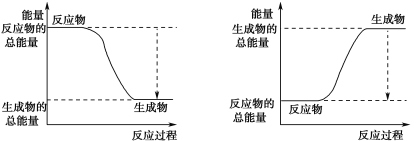
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
