题目内容
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
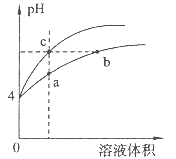

| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.a、b、c三点溶液中水的电离程度a>b>c |
| D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
C
试题分析:根据题意知,盐酸中氢离子主要来自氯化氢的电离,氯化氢为强电解质,全部电离;氯化铵溶液中氢离子来自铵离子的水解,盐类的水解是微弱的。pH都相同的盐酸和氯化铵溶液,氯化铵溶液的浓度远大于盐酸的浓度。某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释,促进铵离子的水解,pH变化大的为盐酸。A、a点所在的曲线代表氯化铵,c点所在的曲线代表盐酸,pH都相同的盐酸和氯化铵溶液,氯化铵溶液的浓度远大于盐酸的浓度,稀释相同的倍数,氯化铵溶液中自由移动离子的浓度大于盐酸中自由移动离子的浓度,a点溶液的导电能力强,错误;B、b点所在的曲线代表氯化铵溶液,根据质子守恒有c(H+)=c(OH-)+c(NH3·H2O),错误;C、a、b、c三点溶液中水的电离程度a>b>c,正确;D、体积和pH都相同的盐酸和氯化铵溶液氯化铵的物质的量大于氯化氢的物质的量,用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb>Vc,错误。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
 HA溶液中逐滴加入0.02mol
HA溶液中逐滴加入0.02mol
