题目内容
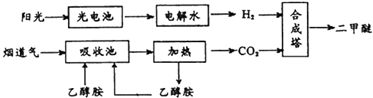
二甲醚(CH3OCH3,沸点为-24.9℃)被称为21世纪的新型能源.科学家利用太阳能分解水生成的氢气与从烟道气中分离出的CO2在催化剂作用下合成二甲醚,并开发出直接以二甲醚为燃料的燃料电池.其合成流程如下:
(1)已知:CH3OCH3(g)、H2(g)的标准燃烧热分别为:△H=-1455.0kJ?mol-1、△H=-285.8kJ?mol-1.写出以CO2、H2合成CH3OCH3的热化学方程式: .
(2)15~20%的乙醇胺.(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.写出吸收CO2反应的化学方程式 .
(3)一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚的选择性(是指转化生成二甲醚的碳占已转化碳的比例)影响结果如图1所示,当控制气流量为28mL?min-1时,则生成0.3mol二甲醚需要通入CO2的物质的量为 .
(4)图2为二甲醚燃料电池示意图.
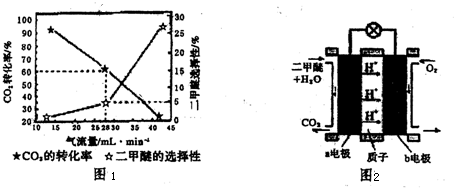
①b电极为 ,a电极的电极反应式为 .
该燃料电池的最大障碍是氧化反应不完全而产生 (填物质名称)而导致通入电极的气体通道堵塞.
②若以1.12L?min-1(标准状况)的速率向该电池中通入二甲醚,用该电池电解500mL 2mol?L-1 CuSO4溶液,通电0.50min后,计算理论上可析出金属铜的质量(写出解题过程).

(1)已知:CH3OCH3(g)、H2(g)的标准燃烧热分别为:△H=-1455.0kJ?mol-1、△H=-285.8kJ?mol-1.写出以CO2、H2合成CH3OCH3的热化学方程式:
(2)15~20%的乙醇胺.(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.写出吸收CO2反应的化学方程式
(3)一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚的选择性(是指转化生成二甲醚的碳占已转化碳的比例)影响结果如图1所示,当控制气流量为28mL?min-1时,则生成0.3mol二甲醚需要通入CO2的物质的量为
(4)图2为二甲醚燃料电池示意图.

①b电极为
该燃料电池的最大障碍是氧化反应不完全而产生
②若以1.12L?min-1(标准状况)的速率向该电池中通入二甲醚,用该电池电解500mL 2mol?L-1 CuSO4溶液,通电0.50min后,计算理论上可析出金属铜的质量(写出解题过程).
分析:(1)依据燃烧热写出热化学方程式,结合盖斯定律计算得到合成甲醚的热化学方程式;
(2)氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(3)先根据二甲醚的选择性求出理论上生成的二甲醚,然后根据物质的量之比等于化学计量数之比求出反应的CO2的物质的量,最后根据CO2的转化率求出实际通入的CO2;
(4)①反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电,由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子;该燃料电池的最大障碍是氧化反应不完全而产生碳堵塞通入电极的气体通道;
②依据二甲醚通入的量计算物质的量,结合电子守恒计算析出铜的质量;
(2)氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(3)先根据二甲醚的选择性求出理论上生成的二甲醚,然后根据物质的量之比等于化学计量数之比求出反应的CO2的物质的量,最后根据CO2的转化率求出实际通入的CO2;
(4)①反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电,由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子;该燃料电池的最大障碍是氧化反应不完全而产生碳堵塞通入电极的气体通道;
②依据二甲醚通入的量计算物质的量,结合电子守恒计算析出铜的质量;
解答:解:(1)已知:CH30CH3(g)、H2(g)的标准燃烧热分别为:△H=-1455.OkJ?mol-1、△H=-285.8kJ?mol-1,
①CH30CH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1455.0kJ?mol-1;
②H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1,
依据盖斯定律②×6-①得到:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-259.8kJ/mol
写出以CO2、H2合成CH3OCH3的热化学方程式为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-259.8kJ/mol,
故答案为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-259.8kJ/mol;
(2)15~20%的乙醇胺.(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作C02吸收剂,乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,结合二氧化碳生成碳酸盐,反应的化学方程式为:2HOCH2CH2NH2+H2O+CO2?(HOCH2CH2NH3)2CO3;
故答案为:2HOCH2CH2NH2+H2O+CO2?(HOCH2CH2NH3)2CO3;
(3)生产0.3mol二甲醚,理论上应生成二甲醚物质的量
=6mol,反应的反应的CO2的物质的量为12mol,实际通入的CO2的物质的量为
=20mol,
故答案为:20mol;
(4)①反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,b为正极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+;该燃料电池的最大障碍是氧化反应不完全而产生碳堵塞通入电极的气体通道;
故答案为:正;CH3OCH3+3H2O-12e-═2CO2+12H+;炭;
②若以1.12L?min-1(标准状况)的速率向该电池中通入二甲醚,用该电池电解500mL 2mol?L-1 CuS04溶液,通电0.50min后,通入二甲醚物质的量=
=0.025mol;依据电极反应电子守恒,CH3OCH3--12e---6Cu2+
n(Cu2+)=0.025mol×6=0.15mol
m(Cu)=0.15mol×64g/mol=9.6g
答:理论上可析出金属铜的质量9.6g;
①CH30CH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1455.0kJ?mol-1;
②H2(g)+
| 1 |
| 2 |
依据盖斯定律②×6-①得到:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-259.8kJ/mol
写出以CO2、H2合成CH3OCH3的热化学方程式为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-259.8kJ/mol,
故答案为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-259.8kJ/mol;
(2)15~20%的乙醇胺.(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作C02吸收剂,乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,结合二氧化碳生成碳酸盐,反应的化学方程式为:2HOCH2CH2NH2+H2O+CO2?(HOCH2CH2NH3)2CO3;
故答案为:2HOCH2CH2NH2+H2O+CO2?(HOCH2CH2NH3)2CO3;
(3)生产0.3mol二甲醚,理论上应生成二甲醚物质的量
| 0.3mol |
| 5% |
| 12mol |
| 60% |
故答案为:20mol;
(4)①反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,b为正极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+;该燃料电池的最大障碍是氧化反应不完全而产生碳堵塞通入电极的气体通道;
故答案为:正;CH3OCH3+3H2O-12e-═2CO2+12H+;炭;
②若以1.12L?min-1(标准状况)的速率向该电池中通入二甲醚,用该电池电解500mL 2mol?L-1 CuS04溶液,通电0.50min后,通入二甲醚物质的量=
| 1.12L/min×0.50min |
| 22.4L/mol |
n(Cu2+)=0.025mol×6=0.15mol
m(Cu)=0.15mol×64g/mol=9.6g
答:理论上可析出金属铜的质量9.6g;
点评:本题考查热化学方程式书写,燃烧热概念,流程分析,图象分析应用,原电池电极反应的书写方法,电子守恒的计算应用,题目难度中等.

练习册系列答案
相关题目

 CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。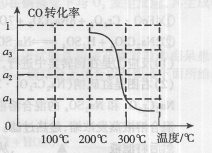
 ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。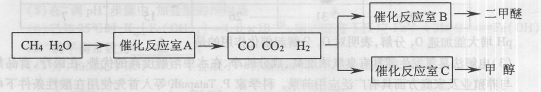
 与H2合成二甲醚的化学方程式为 .
与H2合成二甲醚的化学方程式为 . CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。