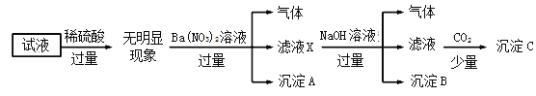
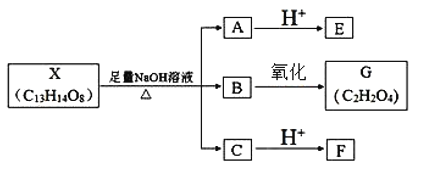
题目内容
【题目】(1)写出一氯甲烷的电子式____,乙烯的结构式____;
(2)乙醇催化氧化的方程式:____;
(3)写出苯和液溴在催化剂作用下生成溴苯的化学方程式___。
【答案】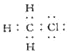
![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O ![]()
【解析】
(1)C最外层4个电子,分别与H、Cl最外层的单电子形成4个共用电子对;乙烯中碳碳之间形成双键,每个碳与2个氢形成C-H键;
(2)乙醇催化氧化,生成乙醛和水;
(3)苯与液溴易发生取代反应生成溴苯和溴化氢。
(1)C最外层4个电子,分别与H、Cl最外层的单电子形成4个共用电子对,一氯甲烷的电子式为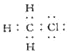 ;乙烯的结构式为
;乙烯的结构式为![]() ;
;
(2)乙醇中含-OH,能发生催化氧化生成乙醛,其反应方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)苯和溴单质在催化剂作用下易发生取代反应,该反应为![]() 。
。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】我国在南海北部神弧海域进行的可燃冰试采成功,这标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰主要成分是甲烷,可以用作燃料和制氢原料。甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整两个过程。发生的主要反应如下:
化学方程式 | 焓变ΔH/(kJ·mol-1) | 活化能Ea/(kJ·mol-1) | |
甲烷氧化 | CH4(g)+2O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | Ⅰ.CH4(g)+H2O(g) | +206.2 | 240.1 |
Ⅱ.CH4(g)+2H2O(g) | +165 | 243.9 |
下列说法不正确的是
A.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
B.反应Ⅱ逆反应活化能Ea=78.9kJ·mol-1
C.初始阶段:甲烷氧化的速率大于甲烷蒸气重整的速率
D.甲烷自热重整方法的突出优点是能量循环利用