题目内容
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) △H = +49 kJmol-1
副反应:H2(g) + CO2(g) ==CO(g) + H2O(g) △H=+41 kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是_______________。
对甲醇水蒸气重整制氢的好处是_______________。
③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为____________(忽略副反应)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)=CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3mol-3min-1。
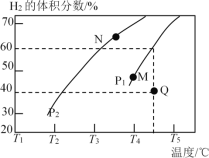
②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:则压强Pl_______P2(填“大于”或“小于”);N点v正_______M点v逆(填“大于”或“小于”);求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
【答案】CH3OH(g)![]() CO(g)+2H2(g) ΔH = +90 kJ/mol 升温 提高甲醇的利用率、有利于抑制CO的生成或抑制副反应发生
CO(g)+2H2(g) ΔH = +90 kJ/mol 升温 提高甲醇的利用率、有利于抑制CO的生成或抑制副反应发生 ![]() ×100% 1.2×104 大于 小于 48 (mol/L)2 正反应方向
×100% 1.2×104 大于 小于 48 (mol/L)2 正反应方向
【解析】
(1)①根据盖斯定律计算所求反应的焓变,从压强和温度角度分析措施;
②适当增大水醇比[n(H2O):n(CH3OH)],可视为增大H2O的量,能使CH3OH转化率增大,生成更多的H2,抑制转化为CO的反应的进行;
③根据主反应方程式计算,平衡体系总压为各组分分压之和;
(2)①根据v逆=kc(CO)c3(H2)计算k的值;
②反应为气体分子数增多的反应,随着反应的进行,体系压强增大,增大压强不利于反应正向进行,反应为吸热反应,温度升高有利于反应正向进行,化学反应平衡时的正反应和逆反应速率相等;根据温度高、压强大使化学反应速率加快分析M、N点速率大小;利用三段式计算平衡时各种物质的物质的量,结合容器的容积得到相应物质的平衡浓度,根据平衡常数表达式可得其平衡常数的数值。然后将加入1 mol CH4和1 mol CO加入反应体系,计算此时的Qc并与K比较,判断平衡移动的方向。
(1)①已知:①CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H = +49 kJ/mol,
CO2(g)+3H2(g) △H = +49 kJ/mol,
②H2(g)+CO2(g)![]() CO(g)+H2O(g) △H=+41kJ/mol,
CO(g)+H2O(g) △H=+41kJ/mol,
根据盖斯定律,反应可由①+②整理可得,CH3OH(g)![]() CO(g)+2H2(g)△H=△H1+△H2=+90kJ/mol;该反应为吸热反应,升高温度既能加快化学反应速率同时可以促使反应正向进行,提高CH3OH平衡转化率,而增大压强能加快化学反应速率,但对正反应不利,所以既能加快反应速率又能提高CH3OH平衡转化率的一种措施是升高温度;
CO(g)+2H2(g)△H=△H1+△H2=+90kJ/mol;该反应为吸热反应,升高温度既能加快化学反应速率同时可以促使反应正向进行,提高CH3OH平衡转化率,而增大压强能加快化学反应速率,但对正反应不利,所以既能加快反应速率又能提高CH3OH平衡转化率的一种措施是升高温度;
②适当增大水醇比[n(H2O):n(CH3OH)],可视为增大H2O的量,能使CH3OH转化率增大,生成更多的H2,抑制转化为CO的反应的进行,所以适当增大水醇比[n(H2O):n(CH3OH)]对甲醇水蒸气重整制氢的好处为:提高甲醇的利用率,有利于抑制CO的生成;
③主反应为:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g),n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,
CO2(g)+3H2(g),n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,
CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)
CO2(g)+3H2(g)
初始压强 0.5p1 0.5p1
转化压强 p p p 3p
平衡压强 0.5p1-p 0.5p1-p p 3p
所以可得p2=(0.5p1-p)+(0.5p1-p)+ p+3p=p1+2p,故p=![]() ,则平衡时甲醇的转化率为α=
,则平衡时甲醇的转化率为α=![]() ×100%
×100%
(2)①根据v逆=kc(CO)c3(H2),由表中数据,c13=![]() mol3/L3,则c2=
mol3/L3,则c2=![]() =0.2mol/L,所以k=
=0.2mol/L,所以k=![]() L3mol3min1=1.2×104 L3mol3min1;
L3mol3min1=1.2×104 L3mol3min1;
②反应为气体分子数增多的反应,随着反应的进行,体系压强增大,增大压强不利于反应正向进行,所以压强p1大于p2;M、N都处于平衡状态,该点的正反应速率等于逆反应速率。由于温度:M>N,压强:M>N,升高温度或增大压强都会使化学反应速率加快,因此N点v正<M点v逆;
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始(mol) 3 3 0 0
转化(mol) -x -x x 3x
平衡(mol) 3-x 3-x x 3x
所以可得![]() =60%,解得x=2,所以平衡时c(CH4)=
=60%,解得x=2,所以平衡时c(CH4)=![]() =
=![]() mol/L,c(H2O)=
mol/L,c(H2O)=![]() mol/L,c(CO)=
mol/L,c(CO)=![]() mol/L,c(H2)=2mol/L,则化学平衡常数为K=
mol/L,c(H2)=2mol/L,则化学平衡常数为K= =48mol2/L2;
=48mol2/L2;
若平衡后再向容器中加入1 mol CH4和1 mol CO,则c(CH4)=![]() mol/L,c(CO)=1mol/L,Qc=
mol/L,c(CO)=1mol/L,Qc=![]() <K,所以化学平衡正向移动直至达到化学平衡。
<K,所以化学平衡正向移动直至达到化学平衡。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】已知反应H2(g)+ I2(g)![]() 2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
化 学 键 | H—H | I—I |
断开1 mol化学键时吸收的能量(kJ) | b | c |
A.该反应中反应物的总能量高于生成物的总能量
B.断开1 mol H-H 键和1 mol I-I 键所需能量大于断开2 mol H-I 键所需能量
C.断开2 mol H-I键所需能量为(a+b+c)kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ