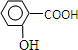
题目内容
(2010?浙江)下列关于实验原理或操作的叙述中,不正确的是( )
分析:本题是一组实验操作或原理的正误判断问题.实验操作的正误,实际根源还是实验原理.液液混合物的分离大多采取萃取分液或蒸馏,如:A考查萃取剂的选择,同学们需掌握萃取剂选择的三个要求.D考查蒸馏的相关知识,根据物质的沸点差异来分离混合物.
解答:解:A、乙醇和水互溶,因此萃取单质碘时不能用无水乙醇代替CCl4,故A说法正确.
B、甘油可以与新制的Cu(OH)2悬浊液反应生成一种绛蓝色的络合物,有明显现象,故B说法正确.
C、纸层析实验中,滤纸上的试样点是不可以浸入展开剂中的,否则试样会溶解在展开剂中.故C说法不正确.
D、乙酸可以和生石灰反应,生成相应的盐,增大沸点差距,更容易蒸馏得到纯净的乙醇,故D说法正确.
故选:C.
B、甘油可以与新制的Cu(OH)2悬浊液反应生成一种绛蓝色的络合物,有明显现象,故B说法正确.
C、纸层析实验中,滤纸上的试样点是不可以浸入展开剂中的,否则试样会溶解在展开剂中.故C说法不正确.
D、乙酸可以和生石灰反应,生成相应的盐,增大沸点差距,更容易蒸馏得到纯净的乙醇,故D说法正确.
故选:C.
点评:本题涉及的化学实验都是经典.同学们在平时的学习中应注重对课本基础实验的研究,多积累,定能熟练解决该类问题.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
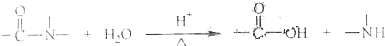


 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.