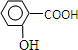
题目内容
(2010?浙江)下列热化学方程式或离子方程式中,正确的是( )
分析:根据热化学方程式书写的注意事项以及对热化学方程式的理解,离子方程式书写时应注意的问题和判断常见的错误,即可解决.
解答:解:A、燃烧热是指1mol可燃物完全燃烧生成稳定的化合物时所放出的能量,气态水不属于稳定的化合物,故A错误;
B、合成氨反应是可逆的,所以0.5mol N2完全反应时放出的热量应该大于19.3kJ,故B错误;
C、一水合氨是弱电解质,离子方程式中要用化学式表示,故C错误;
D、Al2O3与碱反应在溶液中是以Al(OH)4-的形式存在,故D正确;
故选D.
B、合成氨反应是可逆的,所以0.5mol N2完全反应时放出的热量应该大于19.3kJ,故B错误;
C、一水合氨是弱电解质,离子方程式中要用化学式表示,故C错误;
D、Al2O3与碱反应在溶液中是以Al(OH)4-的形式存在,故D正确;
故选D.
点评:热化学方程式与离子方程式书写和正误判断是化学中的重点内容,要细心分析,认真归纳.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
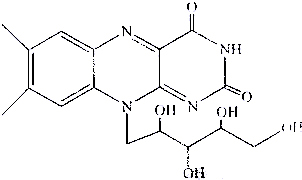


 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.