题目内容
表中原子化热、晶格能、键能的单位都是kJ·mol-1
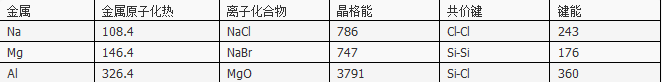
则下列说法正确的是
- A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
- B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
- C.从表中可以看出,氯化钠的熔点比晶体硅高
- D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
B
A不正确,因为晶格能是在反应时1mol离子化合物中的阴、阳离子从相互分离的气态结合成离子晶体时所放出的能量,因此生成物氯化钠的状态应该是气态;反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据键能计算可知,B正确;氯化钠是离子化合物,其熔点比晶体硅低,C不正确;微粒半径越大共价键越弱,D不正确,答案选B。
A不正确,因为晶格能是在反应时1mol离子化合物中的阴、阳离子从相互分离的气态结合成离子晶体时所放出的能量,因此生成物氯化钠的状态应该是气态;反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据键能计算可知,B正确;氯化钠是离子化合物,其熔点比晶体硅低,C不正确;微粒半径越大共价键越弱,D不正确,答案选B。

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
表中原子化热、晶格能、键能的单位都是kJ·mol-1
|
金属 |
金属原子化热 |
离子化合物 |
晶格能 |
共价键 |
键能 |
|
Na |
108.4 |
NaCl |
786 |
Cl-Cl |
243 |
|
Mg |
146.4 |
NaBr |
747 |
Si-Si |
176 |
|
Al |
326.4 |
MgO |
3791 |
Si-Cl |
360 |
则下列说法正确的是( )
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
表中原子化热、晶格能、键能的单位都是kJ·mol-1
|
金属 |
金属原子化热 |
离子化合物 |
晶格能 |
共价键 |
键能 |
|
Na |
108.4 |
NaCl |
786 |
Cl-Cl |
243 |
|
Mg |
146.4 |
NaBr |
747 |
Si-Si |
176 |
|
Al |
326.4 |
MgO |
3791 |
Si-Cl |
360 |
则下列说法正确的是( )
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
表中原子化热、晶格能、键能的单位都是kJ·mol-1
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
则下列说法正确的是
- A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
- B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
- C.从表中可以看出,氯化钠的熔点比晶体硅高
- D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
表中原子化热、晶格能、键能的单位都是kJ·mol-1
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强