题目内容
【题目】氮及氮的化合物在化工研究中是一门重要的课题.
(1)某无机化合物A的相对分子质量为184.在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液pH<7.将18.4gA隔绝空气加热可得到12.8gB和气体单质C.请回答:
写出SCl2与氨反应的化学方程式 .
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJmol﹣1
2C(s)+O2(g)=2CO(g)△H=﹣221.0kJmol﹣1
C(s)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1
(I)汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),简述该设想能否实现的依据: .
(II)汽车尾气转化器中发生的反应:2NO(g)+2CO(g)N2(g)+2CO2(g)△H= .
(III)有容积相同的甲、乙两个密闭容器,甲充入等量的NO和CO气体,乙充入NO气体.
以Ag﹣ZSM﹣5为催化剂,分别在不同温度下同时发生反应,测得相同时间内NO的转化率,绘得图象如图1.
分析图象回答:曲线②NO转化率随温度升高而增大的原因 . 在图2中画出反应2NO(g)+2CO(g)N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图 .
(V)已知常温下HNO2的电离常数K=4.6×10﹣4 , 求0.01molL﹣1的HNO2溶液中c(H+)=molL﹣1 . ( ![]() =2.14)
=2.14)
【答案】
(1)6SCl2+16NH3=S4N4+2S+12NH4Cl
(2)不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;﹣746.5kJ?mol﹣1;反应没有达到平衡,温度越高反应速率越快,转化率越大; ;2.14×10﹣3
;2.14×10﹣3
【解析】解:(1)因为“SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7、A隔绝空气加强热可得到 B和气体单质C”知B是S,A含N、S元素,C是氮气,X是氯化铵.n(A)= ![]() =0.1mol,n(S)=
=0.1mol,n(S)= ![]() =0.4mol,则A中含N:
=0.4mol,则A中含N: ![]() =0.4mol,故A的分子式为S4N4 , 所以SCl2与氨反应生成A和淡黄色单质B及离子化合物X,反应方程式:6SCl2+16NH3=S4N4+2S+12NH4Cl,所以答案是:6SCl2+16NH3=S4N4+2S+12NH4Cl;(2)(I)因为C不完全燃烧时产生CO为放热反应,则2CO(g)=2C(s)+O2(g)△H>0,又熵变减小的反应,△H>0,△S<0,则△H﹣T△S>0,反应任何温度下都不能自发进行;所以答案是:不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;(II)①N2(g)+O2(g)=2NO(g)△H=+180.5kJmol﹣1
=0.4mol,故A的分子式为S4N4 , 所以SCl2与氨反应生成A和淡黄色单质B及离子化合物X,反应方程式:6SCl2+16NH3=S4N4+2S+12NH4Cl,所以答案是:6SCl2+16NH3=S4N4+2S+12NH4Cl;(2)(I)因为C不完全燃烧时产生CO为放热反应,则2CO(g)=2C(s)+O2(g)△H>0,又熵变减小的反应,△H>0,△S<0,则△H﹣T△S>0,反应任何温度下都不能自发进行;所以答案是:不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;(II)①N2(g)+O2(g)=2NO(g)△H=+180.5kJmol﹣1
②2C(s)+O2(g)=2CO(g)△H=﹣221.0kJmol﹣1
③C(s)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1
根据盖斯定律③×2﹣①﹣②得2NO(g)+2CO(g)N2(g)+2CO2(g)△H=﹣393.5×2﹣180.5+221.0=﹣746.5kJmol﹣1 , 所以答案是:﹣746.5kJmol﹣1;(III)根据(3)2NO(g)+2CO(g)N2(g)+2CO2(g)△H=﹣746.5kJmol﹣1 , 则升高温度,平衡向逆反应方向移动,所以NO的转化率应该减小,而曲线②NO转化率随温度升高而增大说明反应没有达到平衡,温度越高反应速率越快,转化率越大;
又2NO(g)+2CO(g)N2(g)+2CO2(g)△H=﹣746.5kJmol﹣1 , 则升高温度,平衡向逆反应方向移动,所以温度越高,平衡时c(N2)越小,则变化趋势图为 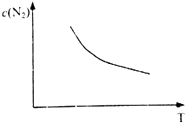 ,所以答案是:反应没有达到平衡,温度越高反应速率越快,转化率越大;
,所以答案是:反应没有达到平衡,温度越高反应速率越快,转化率越大;  .(IV)因为HNO2的电离方程式为HNO2H++NO2﹣ , 又电离常数K=4.6×10﹣4 , 所以K=
.(IV)因为HNO2的电离方程式为HNO2H++NO2﹣ , 又电离常数K=4.6×10﹣4 , 所以K= ![]() =
= ![]() =4.6×10﹣4 , 解得:c(H+)=2.14×10﹣3molL﹣1 , 所以答案是:2.14×10﹣3 .
=4.6×10﹣4 , 解得:c(H+)=2.14×10﹣3molL﹣1 , 所以答案是:2.14×10﹣3 .
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热,以及对弱电解质在水溶液中的电离平衡的理解,了解当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

 步步高达标卷系列答案
步步高达标卷系列答案【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10﹣10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
﹣2 | ﹣3 | ﹣1 | ﹣3 |
回答下列问题:
(1)①在元素周期表中的位置是(周期、族) .
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是;碱性最强的化合物的电子式是: .
(3)比较④和⑦的氢化物的稳定性(用化学式表示) .
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式: .
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式: .