题目内容
(本题共8分)在密闭容器中进行X2(气)+ 3Y2(气) 2Z(气)的反应,其X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),回答:
2Z(气)的反应,其X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),回答:
①各物质的浓度有可能的是 .
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②若a= 时,b=0.15mol/L。
③a、b的取值必须满足的一般条件是 .
④a的取值范围是: .
(本题共8分,每空2分)① B ② 0.15mol/L ③ b+0.3=3a ④ 0.1<a<0.3
【解析】(1)由于反应是可逆反应,转化率不可能是100%的,所以选项ACD都是不可能的,答案选B。
(2)b=0.15mol/L,则消耗物质Y2浓度是0.3mol/L-0.15mol/L=0.15mol/L,则同时消耗X2的浓度是0.05mol/L,所以a=0.2mol/L-0.05mol/L=0.15mol/L。
(3)由于变化量之比是相应的化学计量数之比,所以一定有(0.2-a)×3=0.3-b,解得b+0.3=3a。
(4)由于变化量之比是相应的化学计量数之比,所以(0.2-a)×2=c-0.2,解得2a=0.6-c,由于c大于0,但c小于0.4,所以0.1<a<0.3。

 阅读快车系列答案
阅读快车系列答案(本题共8分)在密闭容器中进行X2(气)+ 3Y2(气) 2Z(气)的反应,其X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),回答:
2Z(气)的反应,其X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),回答:
①各物质的浓度有可能的是 .
| A.c=0.5mol/L | B.b=0.5mol/L | C.c=0.4mol/L | D.a=0.3mol/L |
③a、b的取值必须满足的一般条件是 .
④a的取值范围是: .
(本题共12分)在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
| t c | 初始 | 2min | 4min | 6min | 8min |
| c(A)( mol·L -1) | 2.50 | 2.20 | 2.00 | 2.00 | 2.20 |
| c(B)( mol·L -1) | 1.56 | 2.16 | 2.56 | 2.56 | 2.16 |
| c(C)( mol·L -1) | 0.39 | 0.54 | 0.64 | 0.64 | 1.54 |
(1)前2mim内,v(B)= 。
(2) 到2mim末A 的转化率为 。
(3)该反应的化学方程式为 。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为 (填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为 mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则 是原来的2倍。
a. A的转化率 b. B的平衡浓度 表 c.达到平衡的时间 d.平衡时气体的密度
(本题共12分)在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
|
t c |
初始 |
2min |
4min |
6min |
8min |
|
c(A)( mol·L -1) |
2.50 |
2.20 |
2.00 |
2.00 |
2.20 |
|
c(B)( mol·L -1) |
1.56 |
2.16 |
2.56 |
2.56 |
2.16 |
|
c(C)( mol·L -1) |
0.39 |
0.54 |
0.64 |
0.64 |
1.54 |
请填空:
(1)前2mim内,v(B)= 。
(2) 到2mim末A 的转化率为 。
(3)该反应的化学方程式为 。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为 (填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为 mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则 是原来的2倍。
a. A的转化率 b. B的平衡浓度 表 c.达到平衡的时间 d.平衡时气体的密度
(本题共8分)
水煤气法制甲醇工艺流程框图如下
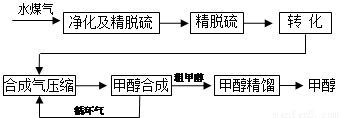
(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
②下列能提高碳的平衡转化率的措施是 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4
(g)+3/2O2 (g) CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
|
物质 |
H2 |
CO |
CH3OH |
|
浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是 。